 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Краткие теоретические сведения. С распределением вещества между двумя фазами встречаются во многих технологических процессах – растворения
|
|
С распределением вещества между двумя фазами встречаются во многих технологических процессах – растворения, выщелачивания, экстракции, сорбции и т.д. Экстракция – процесс переноса растворенного вещества из одной жидкой фазы в другую, при условии, что обе жидкие фазы не смешиваются друг с другом. Обычно распределение (перенос) растворенного вещества осуществляется между водным и органическим растворами. Жидкостная экстракция используется для разделения компонентов гомогенных жидких систем.
В случае системы с физическим распределением компонентов отсутствует химическое взаимодействие между распределяемым веществом и экстрагентом. Экстракция идет за счет различной растворимости компонентов в органической и водной фазах. В процессах физического распределения, как правило, участвуют простые вещества или соединения с малополярными ковалентными связями. Такие экстракционные системы чаще используют для разделения смеси органических веществ или выделения органических компонентов из водных растворов, грунтов и др. Экстракция за счет химического взаимодействия сопровождается образованием сложных комплексных соединений экстрагируемого вещества с органическим компонентом. Эффективность процесса определяется прочностью комплексов, образуемых компонентами. Данный метод в основном используется для извлечения и разделения ионов металлов. Здесь экстрагент – органический раствор экстракционного реагента, способного к образованию химических соединений с ионами или молекулами извлекаемого вещества в органическом растворителе. Образующееся химическое соединение должно быть нерастворимо в воде и хорошо растворяться в выбранном органическом растворителе. Молекула экстракционного реагента должна иметь гетерополярное строение и состоять из неполярного углеводородного радикала и полярной функциональной группы. Углеводородный радикал обеспечивает малую растворимость в воде и высокую растворимость в разбавителе, а функциональная группа – образование химической связи с целевым компонентом. В качестве разбавителей обычно применяют ароматические или алифатические углеводороды, хлорпроизводные углеводородов, спирты, нитробензол и др. В зависимости от реакции, лежащей в основе процесса экстракции различают следующие основные типы химических экстракционных систем.
Катионообменная экстракция - экстракция металлов, находящихся в водных растворах в виде катионов (простых и комплексных) за счет обмена экстрагируемого катиона на протон или другой катион экстрагента. Экстрагенты – карбоновые кислоты или их соли, кислые эфиры, фенолы.
Анионообменная экстракция – экстракция металлов, находящихся в водных растворах в виде анионов за счет обмена экстрагируемого аниона на анион экстрагента. Экстрагенты – органические основания и их соли.
Экстракция с образованием хелатных комплексов или координационная экстракция. Экстрагируемое соединение образуется в результате комплексообразования между молекулами или ионами экстракционного агента и ионом экстрагируемого металла-комплексообразователя.
Экстракция ионных ассоциатов – экстракция неорганических молекул из водного раствора нейтральными молекулами экстрагента за счет образования в экстракте ионных ассоциатов (солей), состоящих из органических катионов и неорганических анионов.
Экстракция посредством сольватации катионов металла или водорода. Экстрагенты содержат полярный атом кислорода, связанный либо с углеродом, либо с фосфором. Вместо кислорода в этих соединениях может быть любой другой донорный атом.
Для количественной характеристики полноты и селективности извлечения целевого компонента в процессе экстракции используют следующие показатели.
1. Коэффициент распределения, который подчиняется закону распределения Нернста: «каждое из растворенных веществ распределяется между жидкими несмешивающимися фазами со своим индивидуальным коэффициентом распределения». Коэффициент распределения представляет собой соотношение активностей вещества в органической и водной фазе:
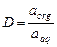 .
.
При небольших концентрациях растворов и отсутствии процессов диссоциации, ассоциации и других химических превращений активность вещества можно заменить на его концентрацию:
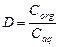 .
.
Если D >1, то растворенный компонент будет концентрироваться в органической фазе. Для определения коэффициента распределения в широком диапазоне концентраций и предельной емкости экстрагента используют изотерму экстракции, представляющую собой зависимость равновесной концентрации целевого компонента в экстракте (Сorg) от равновесной концентрации в рафинате (Сaq).
2. Степень извлечения. Представляет собой отношение количества вещества в органической фазе к его общему содержанию в системе.
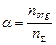 .
.
3. Если при экстракции происходит химическая реакция растворенного вещества с экстрагентом, количественным показателем процесса экстракции, также является константа равновесия процесса экстракции.
Для физико-химической характеристики процесса экстракции следует знать, какие параметры будут влиять на экстракционное равновесие и, как следствие, на величину коэффициента распределения. Например, при экстракции ионов металла Mez+ нафтеновой кислотой HR, не смешивающейся с водой, можно записать такую схему реакции:
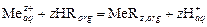 .
.
При не слишком высоких концентрациях ионов можно считать g±» 1. Тогда константу равновесия можно записать в виде уравнения:
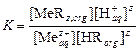 .
.
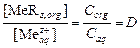 ,
,
тогда
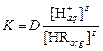 .
.
После логарифмирования и небольших преобразований получаем уравнение
 ,
,
которое связывает константу равновесия и коэффициент распределения, а также показывает зависимость коэффициента распределения от концентрации экстрагента и рН.
Получив экспериментальную зависимость коэффициента распределения от, например, рН при постоянной концентрации экстрагента можно определить сольватное число z и константу равновесия процесса экстракции.
Контрольные вопросы
1. В чем сущность процесса экстракции?
2. Чем характеризуется состояние экстракционного равновесия?
3. Что означает «физическое распределение» и «химическое распределение» компонента в экстракционной системе?
4. Какая характеристика вещества лежит в основе физической экстракции?
5. Области применения метода физической экстракции.
6. За счет чего протекает «химическая экстракция»?
7. Чем определяется эффективность процесса химической экстракции?
8. Что представляет собой экстрагент в химической экстракции?
9. Строение химического экстрагента.
10. Основные типы химических экстракционных систем и реакции, лежащие в их основе.
11. Основные количественные характеристики процесса экстракции: коэффициент распределения, степень извлечения, константа равновесия.
12. Взаимосвязь константы равновесия и коэффициента распределения при экстракции карбоновыми кислотами.
13. Как определить сольватное число и константу равновесия на основании экспериментальных данных?
Дата публикования: 2014-11-18; Прочитано: 824 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
