Из-за того, что давление пара растворителя над раствором меньше давления пара над чистым растворителем, все растворы замерзают при более низкой температуре, а кипят при более высокой температуре. Рассмотрим замерзание и кипение растворов, растворителем которого является вода:
| Замерзание
| Кипение
|
Понижение температуры замерзания раствора ΔTзам не зависит от природы растворенного вещества и определяется лишь соотношением числа частиц растворителя и растворенного вещества.
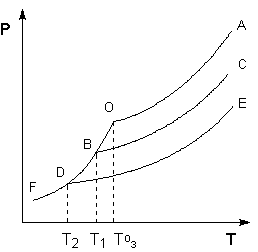 ОF есть зависимость давления пара над твердым растворителем, а кривые ОА, ВС, DE – зависимости давления пара над чистым растворителем и растворами с возрастающими концентрациями соответственно.T1=
ОF есть зависимость давления пара над твердым растворителем, а кривые ОА, ВС, DE – зависимости давления пара над чистым растворителем и растворами с возрастающими концентрациями соответственно.T1= 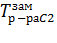 , T2= , T2=  , T0з= , T0з=  Можно показать, что понижение температуры замерзания раствора ΔTзам прямо пропорционально моляльной концентрации раствора:
Можно показать, что понижение температуры замерзания раствора ΔTзам прямо пропорционально моляльной концентрации раствора:
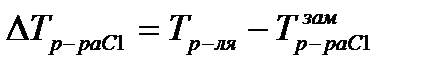


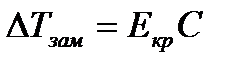 Уравнение называют вторым законом Рауля. Коэффициент пропорциональности Eкр – криоскопическая постоянная растворителя – определяется природой растворителя.
Eкр=1,89
Уравнение называют вторым законом Рауля. Коэффициент пропорциональности Eкр – криоскопическая постоянная растворителя – определяется природой растворителя.
Eкр=1,89
| Любая жидкость – растворитель или раствор – кипит при той температуре, при которой давление насыщенного пара становится равным внешнему давлению. Соответственно температуры, при которых изобара Р = 1 атм. пересечет кривые ОА, ВС и DE, представляющие собой зависимости давления пара над чистым растворителем и растворами с возрастающими концентрациями соответственно, будут температурами кипения этих жидкостей
 T1=
T1= 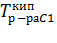 , T2= , T2= 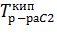 , T0к= , T0к= 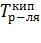
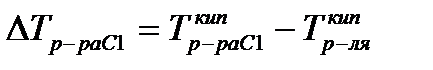


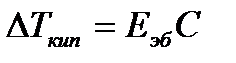 Eэб- эбулиоскопическая постоянная растворителя, не зависящая от природы растворенного вещества.
Eэб=0,52
Eэб- эбулиоскопическая постоянная растворителя, не зависящая от природы растворенного вещества.
Eэб=0,52
|
| Константы являются табличными величинами, определены не только для воды, но и для большинства органических растворителей. В случае отстувия константы можно рассчитать с помощью уравнения ВантГоффа:
|

| 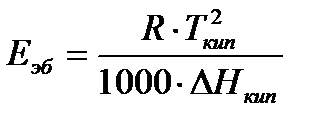
|
Концентрация должна быть моляльной, т е.
Ввиду того, что масса растворителя не всегда берется равной 1000, в уравнения вводят массу растворителя G. Тогда
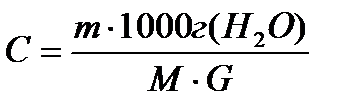
|
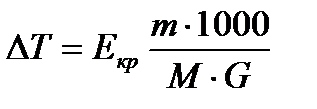
 Метод определения молярной массы вещества по понижению температуры замерзания вещества называется криоскопией, а прибор, в котором проводится опыт называется криоскоп.
Метод определения молярной массы вещества по понижению температуры замерзания вещества называется криоскопией, а прибор, в котором проводится опыт называется криоскоп.
| 
 Метод определения молярной массы вещества по повышению температуры кипения раствора называется эбулиоскопией.
Метод определения молярной массы вещества по повышению температуры кипения раствора называется эбулиоскопией.
|

 ОF есть зависимость давления пара над твердым растворителем, а кривые ОА, ВС, DE – зависимости давления пара над чистым растворителем и растворами с возрастающими концентрациями соответственно.T1=
ОF есть зависимость давления пара над твердым растворителем, а кривые ОА, ВС, DE – зависимости давления пара над чистым растворителем и растворами с возрастающими концентрациями соответственно.T1= 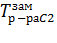 , T2=
, T2=  , T0з=
, T0з=  Можно показать, что понижение температуры замерзания раствора ΔTзам прямо пропорционально моляльной концентрации раствора:
Можно показать, что понижение температуры замерзания раствора ΔTзам прямо пропорционально моляльной концентрации раствора:
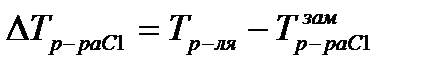


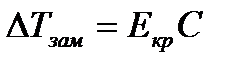 Уравнение называют вторым законом Рауля. Коэффициент пропорциональности Eкр – криоскопическая постоянная растворителя – определяется природой растворителя.
Eкр=1,89
Уравнение называют вторым законом Рауля. Коэффициент пропорциональности Eкр – криоскопическая постоянная растворителя – определяется природой растворителя.
Eкр=1,89
 T1=
T1= 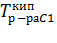 , T2=
, T2= 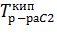 , T0к=
, T0к= 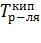
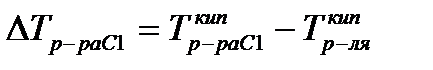


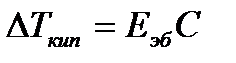 Eэб- эбулиоскопическая постоянная растворителя, не зависящая от природы растворенного вещества.
Eэб=0,52
Eэб- эбулиоскопическая постоянная растворителя, не зависящая от природы растворенного вещества.
Eэб=0,52

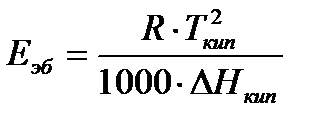
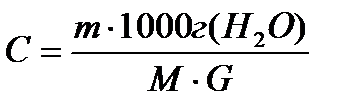
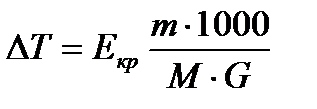
 Метод определения молярной массы вещества по понижению температуры замерзания вещества называется криоскопией, а прибор, в котором проводится опыт называется криоскоп.
Метод определения молярной массы вещества по понижению температуры замерзания вещества называется криоскопией, а прибор, в котором проводится опыт называется криоскоп.

 Метод определения молярной массы вещества по повышению температуры кипения раствора называется эбулиоскопией.
Метод определения молярной массы вещества по повышению температуры кипения раствора называется эбулиоскопией.