 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Адсорбционные явления. Дисперсные системы
|
|
Цель работы: Изучение влияния природы адсорбента, адсорбтива и растворителя на адсорбцию; приобретение навыков разделения смеси веществ методами хроматографии; изучение способов получения и свойств дисперсных систем.
Теория: Классификация дисперсных систем. Оптические и молекулярно-кинетические свойства дисперсных систем (броуновское движение, диффузия, седиментация). Эффект Фарадея-Тиндаля. Строение коллоидных систем. Правило Панета-Фаянса. Коагуляция и пептизация. Правило Шульце-Гарди. Поверхностные явления. Сорбция (абсорбция, адсорбция, хемосорбция). ПАВ. Хроматография.
Дисперсные системы – гетерогенные двух- или многофазовые системы, состоящие из частиц дисперсной фазы и окружающей их дисперсионной среды.
| Дисперсная фаза | Непрерывная фаза (дисперсионная среда) | Обозна-чение | Примеры |
| Системы с жидкой дисперсионной средой | |||
| Твердая | Жидкая | Т/Ж | высокодисперсные золи (краски), связнодисперсные системы или гели (желе, агар-агар) и суспензии или взвеси |
| Жидкая | Жидкая | Ж1/Ж2 | эмульсии (нефть, молоко, майонез, водоэмульсионные краски) |
| Газообразная | Жидкая | Г/Ж | пены (мыльная пена, взбитые сливки) |
| Системы с газообразной дисперсионной средой или аэрозоли | |||
| Твердая | Газообразная | Т/Г | дым, пыль |
| Жидкая | Газообразная | Ж/Г | туман, облака |
| Системы с твердой дисперсионной средой | |||
| Твердая | Твердая | Т1/Т2 | горные породы, сплавы, цветные стекла |
| Газообразная | Твердая | Г/Т | твердые пены (пенопласты, пенобетон, пемза, шлак, хлебобулочные изделия) |
| Жидкая | Твердая | Ж/Т | масло, жемчуг, клетки живых организмов |
Оптическое свойство коллоидных систем – опалесценция, т.е. рассеивание света малыми частицами, приводящее, в частности, к возникновению эффекта Фарадея-Тиндаля – луч света в дисперсной системе становится видимым.
Нарушение агрегативной устойчивости, при которой происходит объединение частиц в агрегаты, называют коагуляцией.
Правило Гарди – коагуляцию вызывают ионы, заряженные противоположно коллоидным частицам. Чем больше заряд иона, тем больше его коагулирующая способность.
Причем коагулирующая способность иона пропорциональна приблизительно шестой степени заряда коагулирующего иона – правило Шульце.
Процесс, обратный коагуляции, т. е. переход (диспергация) свежеобразованного осадка или геля в золь, называется пептизацией.
Адсорбция – изменение концентрации вещества на границе раздела фаз. Адсорбция происходит на любых межфазовых поверхностях, и адсорбироваться могут любые вещества. Адсорбция уменьшается с повышением температуры.
Абсорбция – поглощение одного вещества другим не ограничивающееся поверхностным слоем, а происходящее во всем объеме сорбента (растворение газов в жидкостях).
Поверхностно-активные вещества (ПАВ) – химические соединения, способные адсорбироваться на границе раздела фаз и снижать поверхностное натяжение.
Хроматография – метод разделение сложных смесей путем адсорбции в динамических условиях.
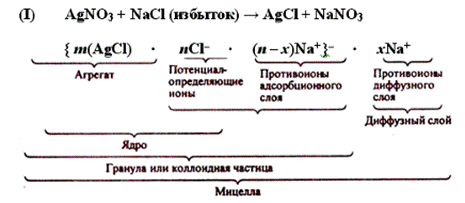
Коллоидные частицы обычно имеют сложную структуру, которая зависит от условий получения золей, стабилизатора и других факторов. Согласно правилу Панета-Фаянса – адсорбируются преимущественно ионы, входящие в состав агрегата, сходные с ними или образующие нерастворимые осадки с ионами агрегата.
Формула мицеллы золя хлорида серебра в избытке хлорида натрия:
Оборудование и реактивы
Воронки, колбы, карандаш, линейка, мерные цилиндры, проекционный фонарь, пробирки, пробиркодержатель, пульверизатор, спички, спиртовка, стеклянные палочки, фильтровальная и хроматографическая бумага, химический стакан.
Активированный уголь (к), каолин / глина (к); дистиллированная вода; растворы: аммиак NH3 (конц.), хлорид железа (III) FeCl3 (2%), сульфат алюминия Al2(SO4)3 (конц.), гексацианоферрат (II) калия K4[Fe(CN)6]; водный раствор эозина и метиленового синего, спиртовой раствор метиленового синего; фенолфталеин.
Эксперимент: выполните задания, составьте уравнения реакций, назовите вещества, запишите наблюдения и вывод.
Опыт 1. Влияние природы адсорбента и адсорбтива на адсорбцию
В одну пробирку поместите немного каолина (глины), в другую – немного активированного угля. В каждую пробирку добавьте по 5 мл водного раствора смеси эозина и метиленового синего. Содержимое пробирок взбалтывайте 2–3 мин. и затем отфильтруйте. Запишите наблюдения и объясните влияние природы адсорбента на адсорбцию.
Опыт 2. Влияние природы растворителя на адсорбцию
В одну пробирку налейте 10 мл водного раствора метиленового синего, в другую – такой же объем в равной концентрации спиртовой раствор метиленового синего.
В каждую пробирку внесите на кончике шпателя примерно равную массу активированного угля; содержимое взболтайте и отфильтруйте. Сравните интенсивность окраски фильтратов. Объясните опыт.
 Опыт 3. Разделение смеси веществ методом бумажной хроматографии
Опыт 3. Разделение смеси веществ методом бумажной хроматографии
Вырежьте из хроматографической бумаги полоску 2–3 см шириной и 8–10 см длиной. На расстоянии 1 см от нижнего края по линейке карандашом проведите тонкую линию (линия старта).
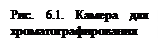 В центр линии тонким капилляром нанесите раствор (диаметр пятна 3–4 мм), содержащий катиона Cu2+ и Fe3+. Высушив бумагу на воздухе, закрепите ее с помощью двух соединенных резиновыми колечками стеклянных палочек и опустите в стакан с дистиллированной водой (рис. 6.1). Глубина погружения полоски бумаги 2–3 мм.
В центр линии тонким капилляром нанесите раствор (диаметр пятна 3–4 мм), содержащий катиона Cu2+ и Fe3+. Высушив бумагу на воздухе, закрепите ее с помощью двух соединенных резиновыми колечками стеклянных палочек и опустите в стакан с дистиллированной водой (рис. 6.1). Глубина погружения полоски бумаги 2–3 мм.
При поднятии воды на высоту 6–7 см выньте полоску из стакана и отметьте карандашом линии подъема растворителя (линия фронта).
Высушив хроматограмму на воздухе, смочите ее из пульверизатора раствором K4[Fe(CN)6]. Отметьте число и окраску зон. Измерьте расстояние от центра каждой зоны до линии старта и составьте уравнения реакций.
Опыт 4. Получение золя гидроксида железа (III) методом конденсации
В пробирку налейте 10 мл дистиллированной воды и нагрейте до кипения. В кипящую воду добавьте 5 капель раствора FeCl3 и продолжайте нагревание до появления красно-бурого золя. В соответствии с правилом избирательной адсорбции Панета–Фаянса схема запишите строения мицеллы.
Для наблюдения эффекта Фарадея–Тиндаля через пробирку с золем пропустите луч света проекционного фонаря под углом 90°.
Опыт 5. Получение золя гидроксида железа (III) методом пептизации (диспергирования)
В пробирку налейте 2 мл раствора FeCl3 и прибавьте по каплям раствор NH3 до полного осаждения Fe(OH)3. Слейте жидкость над полученным осадком и промойте его, приливая дистиллированную воду и повторяя декантацию до полного удаления аммиака. К промытому осадку добавьте 5 мл дистиллированной воды и 5–10 капель насыщ. раствора FeCl3, смесь перемешайте 10 мин. Запишите схему строения мицеллы. Наблюдайте, образуется ли эффект Фарадея–Тиндаля.
Опыт 6. Коагуляция золя гидроксида железа (III) электролитами
К коллоидно-дисперсным системам, полученным в опытах 5 и 6, добавьте по несколько капель конц. раствора Al2(SO4)3. Коагуляцию, по правилу Шульце–Гарди, вызывают ионы _____________. Запишите наблюдения и составьте уравнения реакций. Наблюдайте, образуется ли эффект Фарадея–Тиндаля.
Контрольные задания
1. Написать формулу мицеллы золя иодида серебра, полученного добавлением 40 мл раствора AgNO3 с концентрацией 0,02 моль/л к 50 мл раствора KI с концентрацией 0,001 моль/л.
2. Написать формулу мицеллы золя гидроксида алюминия, полученного из осадка пептизацией раствором гидроксида натрия.
3. Сравнить свойства коллоидно-дисперсных систем и истинных растворов.
4. Какими воздействиями можно вызвать пептизацию осадка?
5. Перечислить основные применения коллоидных ПАВ.
6. Какой из электролитов Na2SO4 или MgCl2 будет обладать большей коагулирующей способностью для золя иодида серебра, полученного смешением равных объемов раствора иодида калия с концентрацией 0,01 моль/л и раствора нитрата серебра с концентрацией 0,015 моль/л?
7. Какие ионы электролитов Na2SO4 и K3[Fe(CN)6] являются коагулирующими для гидрозоля гидроксида железа (III) полученного методом гидролиза?
8. Воздействием каких факторов можно вызвать коагуляцию лиофобных золей?
9. Что называется кинетической и агрегативной устойчивостью золей?
10. Назвать методы очистки коллоидно-дисперсных систем от примесей: а) растворенных низкомолекулярных веществ, б) грубодисперсных примесей.
11. Описать принцип работы и области применения ультрафильтра.
12. Что такое диализ, и для каких целей его применяют. Как устроен простейший диализатор?
13. Что называется границей раздела фаз? По какому принципу классифицируют границы раздела фаз?
14. Объяснить характер влияния природы адсорбента и адсорбтива на адсорбцию.
15. Привести примеры наиболее часто использующихся в практике адсорбентов.
Пример. Может ли образоваться осадок Mg(OH)2, если смешать равные объемы 0,5 М раствора MgCl2 и 0,1 М раствора NaOH?
Решение
При сливании двух равных объемов суммарный объем раствора увеличится вдвое, а концентрация уменьшится вдвое, то есть концентрация раствора MgCl2 будет равной 0,5 / 2 = 0,25 моль/л, а концентрация NaOH – равной 0,1 / 2 = 0,05 моль/л.
Mg2+ + 2ОH–  Mg(OH) 2
Mg(OH) 2
ПР[Mg(OH)2] = [Mg2+][OH–]2 = 5,00 • 10–12
Находим произведение концентраций ионов [Mg2+ ][OH–]2 = 0,25 • 0,052 = 6,25 • 10–4. Сопоставляя полученную величину 6,25 • 10–4 с табличным значением ПР = 5,00 • 10–12, находим, что рассчитанное произведение концентраций ионов превышает ПР[Mg(OH)2], т. е. раствор пересыщен и осадок должен образоваться.
Дата публикования: 2014-11-04; Прочитано: 2750 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
