 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
РАСТВОРЫ. Теория: Истинные растворы и механизм процесса растворения
|
|
Цель работы: Изучение физико-химической природы процесса растворения, свойств растворов, освоение навыков приготовления растворов заданной концентрации и методики их количественного анализа.
Теория: Истинные растворы и механизм процесса растворения. Классификация растворов. Растворимость. Влияние различных факторов на растворимость. Тепловые эффекты при растворении. Насыщенные и ненасыщенные растворы. Произведение растворимости. Условия образования и растворения осадков. Концентрация растворов, способы ее выражения.
Раствор – гомогенная система переменного состава, состоящая из двух или более компонентов и находящаяся в состоянии химического равновесия.
Согласно закону Рауля: относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного нелетучего вещества.
Присутствие растворенного вещества, наряду с понижением давления насыщенного пара над раствором, повышает температуру кипения и понижает температуру замерзания.
В соответствии с законом Рауля, и повышение температуры кипения, и понижения температуры замерзания растворов по сравнению с чистым растворителем (Δt), пропорциональны моляльной концентрации растворенного вещества: Δt = К ∙ С m, где К – коэффициент пропорциональности; Ст – моляльность раствора.
Методы криоскопии и эбулиоскопии позволяют определить молярную массу недиссоциирующих при растворении веществ по понижению температуры замерзания и повышению температуры кипения растворов известной концентрации: M = K∙1000∙m/Δt ∙m1, где т – масса вещества (г), М – молярная масса, т1 – масса растворителя.
Способы выражения концентрации растворов:
1. Массовая доля (ω) – отношение массы растворенного вещества (mB) к массе раствора (mP):
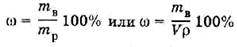
2. Мольная доля (N) – отношение количества растворенного вещества (или растворителя) к сумме количеств всех веществ, составляющих раствор.
N2= n2 / (n1 + n2) или N1= n1 / (n1 + n2) (моль),
где n1 и n2 – соответственно количества вещества растворителя и растворенного вещества.
3. Молярная концентрация (СМ или М) – отношение количества растворенного вещества (n), содержащегося в 1 л раствора (V):
СМ = n / V = m / (M·V) (моль/л),
Раствор, в 1 л которого содержится 1 моль растворенного вещества, называется одномолярным (обозначается 1 М); 0,1 моль растворенного вещества, называется децимолярным (обозначается 0,1 М); 0,01 моль растворенного вещества, называется сантимолярным (обозначается 0,01 М).
4. Моляльность или моляльная концентрация (Сm) – отношение количества растворенного вещества (n), приходящееся на 1000 г растворителя:
Сm = n ∙ 1000 / m1 = m2 ∙ 1000 / (М ∙ т2) (моль/кг),
где т1 – масса растворителя, т2 – масса растворенного вещества, М – молярная масса растворенного вещества.
5. Нормальность или нормальная (эквивалентная) концентрация (СН или Н) – отношение числа эквивалентов (Э) или эквивалентных масс (mЭ) растворенного вещества к объему раствора:
СН = m / (mЭ ∙ V) или СН = m / (М ∙ Э ∙ V) (моль/л; г∙экв/л),
где m – масса растворенного вещества, mЭ – эквивалентная масса растворенного вещества, V – объем раствора, Э – эквивалент, М – молярная масса растворенного вещества.
Вещества реагируют в эквивалентных количествах. Объемы растворов реагирующих веществ обратно пропорциональны их нормальностям:
V1 / V2 = CH2 / CH1 или V1 / V2 = Н2 / Н1
где V1 и CH1 (Н1) – объем и нормальность первого раствора, V2 и CH2 (Н2) – объем и нормальность второго раствора.
Сравнение формул для определения молярной и нормальной концентраций
СМ = n / V = m / (M ∙ V)
СН = m / (М ∙ Э ∙ V)
показывает, что если эквивалент растворенного вещества Э = 1 моль, СМ = СН. Эквивалент, равный единице, имеют растворы одноосновных кислот (HCl, HNO3 и т.д.), однокислотных оснований (NaOH, KOH и т.д.), солей катион и анион которых однозарядные (KCl, NaNO3 и т.д.). Если же эквивалент растворенного вещества не равен 1 моль, то формула соотношения молярной и нормальной концентраций имеет вид: СМ = СН · Э.
Оборудование и реактивы
Ареометры, бюретки (50 мл), колбы (250 мл), мерные цилиндры, пипетки (20–25 мл), пробирки, стеклянные трубки, спиртовка, спички, термометры, технические весы с разновесами, штатив, химические стаканы;
Гидроксид натрия NaOH (к), хлорид натрия NaCl (к), нитрат аммония NH4NO3 (к), хлорид кальция CaCl2 (к);
Растворы: серная кислота H2SO4 (разб.) или соляная кислота HCl (разб.), хлорид натрия NaCl (10%), титрованный гидроксид натрия NaOH (0,1 М), охладительная смесь (лед + NaCl).
Эксперимент: выполните задания, составьте уравнения реакций, назовите вещества, запишите наблюдения и вывод.
Опыт 1. Тепловые эффекты при растворении
1.1. В пробирку с 5 мл воды (измерьте заранее ее температуру t0 = _______°С) внесите немного твердого NaOH (или КОН), помешайте стеклянной палочкой и отметьте изменение температуры (t = _______°С).
1.2. Проведите аналогичный опыт с NH4NO3 (к) (t = __________°С).
Опыт 2. Изменение температуры замерзания и температуры кипения растворов
2.1. Две пробирки наполните наполовину: одну водой, другую – 10%-ным раствором NaCl. Поместите их в стакан с охладительной смесью (лед с солью) и отметьте температуру замерзания Н2О (tзам = __________°С) и раствора NaCl (tзам = __________°С).
2.2. Две пробирки наполните наполовину водой, а одну из них внесите 1 г СаСl2. Нагрейте до кипения и измерьте температуру кипения Н2О (tкип = _________°С) и раствора СаСl2 (tкип = __________°С).
Опыт 3. Приготовление растворов с определенной массовой долей из твердого вещества и воды
Задание: I вариант – приготовьте 50 г раствора NaCl с массовой долей вещества в растворе 5%; II вариант – приготовьте 50 г раствора NaCl с массовой долей вещества в растворе 3%.
Расчитайте массу NaCl, необходимого для приготовления 50 г 5%-ного (или 3%) раствора NaCl по формуле вычисления массовой доли:
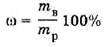
Масса воды, необходимая для приготовления 50 г 5%-ного (или 3%) раствора NaCl:
m(H2O) = m(раствора) – m(соли)
Взвесьте на технических весах необходимое количество соли, отмерьте мерным цилиндром нужный объем воды и растворите приготовленную соль. Затем налейте в цилиндр 40 мл полученного раствора NaCl и измерьте плотность ареометром, сравните ее с данными таблицы. Плотность полученного раствора составляет __________ г/мл. После измерения ареометр промойте водой, осторожно вытрете досуха и поставьте в набор.
Рассчитайте молярность и нормальность полученного раствора.
Опыт 4. Приготовление раствора заданной концентрации из более концентрированного раствора и воды
Задание: I вариант – приготовьте 50 мл 0,1 М раствора H2SO4 (или HCl) из раствора, имеющегося в лаборатории; II вариант – приготовьте 50 мл 0,2 М раствора H2SO4 (или HCl) из раствора, имеющегося в лаборатории.
Измерите плотность исходного раствора кислоты ареометром (ρ =_________г/мл). По табличным данным определите массовую долю кислоты (ω = __________%), соответствующую найденной плотности раствора. Рассчитайте, какое весовое количество этой кислоты нужно для приготовления 50 мл 0,1 М раствора, а затем пересчитайте полученную величину на объем:
1) найдем, сколько граммов вещества кислоты содержится в 50 мл 0,1 М раствора исходя из формулы:
СM = m(в-ва ) / M(в-ва) • V(р-ра)
2) найдем массу исходного раствора кислоты исходя из формулы:
ω = m(в-ва) • 100% / m(р-ра)
3) найдем объем раствора по формуле V = m • ρ
Отмерьте маленьким цилиндром (или градуированной пипеткой) рассчитанный объем исходного раствора H2SO4 и вылейте его в мерную колбу с небольшим количеством воды, а затем доведите уровень воды (по каплям) до метки 50 мл. Перемешайте раствор. Расчет молярной концентрации (молярности) полученного раствора (моль/л):
________________________________________________________________
Расчет нормальной концентрации полученного раствора (моль/л):
________________________________________________________________
В следующем опыте установите концентрацию полученного раствора H2SO4 титрованием 0,1 М раствором NaOH.
Опыт 5. Титрование
Заполните бюретку до нулевой отметки титрованным 0,1 М раствором NaOH. Налейте в коническую колбу пипеткой 10 мл раствора серной кислоты, полученного в предыдущем опыте, и добавьте 2–3 капли фенолфталеина.
Под бюреткой на белый лист бумаги поставьте коническую колбу с раствором кислоты так, чтобы носик бюретки входил внутрь колбы, а шарик в резиновом шланге находился немного выше горла колбы. Приливайте небольшими порциями раствор щелочи к раствору кислоты при непрерывном перемешивании раствора в колбе. Титруйте до появления устойчивой розовой окраски, не исчезающей в течение 30 с.
Запишите объем израсходованного раствора щелочи с точностью до 0,1 мл положение уровня раствора в бюретке.
Титрование повторите 3 раза. Объемы израсходованной щелочи не должны отличаться больше чем на 0,2 мл (в расчетах используйте среднее значение).
| Титрование | V р-ра NaOH, мл | Среднее значение V р-ра NaOH, мл |
Рассчитайте нормальность раствора кислоты по формуле:
V1 / V2 = CH2 / CH1
Пересчитайте нормальность кислоты на молярность. Высчитайте процент ошибки по формуле: П = (СМ теор – СМ пр) ∙ 100% / СМ теор
Контрольные задания
1. Сколько граммов NaNO3 и воды необходимо для приготовления 1,6 кг раствора массовой долей 10%?
2. Сколько граммов Na2SO4 необходимо растворить 400 г воды для приготовления раствора массовой долей 8%?
3. Сколько граммов KCl и воды необходимо взять для приготовления 500 г раствора массовой долей 70%?
4. Какова массовая доля вещества в растворе, полученном при растворении 45 г ВаСl2 в 300 мл воды?
5. В 850 г воды растворили 40 г AgNO3. Вычислить массовую долю вещества в полученном растворе.
6. Сколько граммов Na2SO3 потребуется для приготовления 4 л раствора, массовой долей 8%, плотность которого равна 1,075 г/мл?
7. Сколько граммов HCl содержится в 550 мл раствора массовой долей 10%, плотность которого 1,05 г/мл?
8. Сколько хлороводорода содержится в 40 мл 38,16%-ного раствора соляной кислоты плотностью 1,195 г/мл?
9. К 160 г раствора MgCl2 массовой долей 16% добавили 200 г воды. Определите массовую долю вещества в полученном растворе.
10. 300 г 50%-ного раствора K2SO4 выпаривали до тех пор, пока масса раствора не стала равной 220 г. Определите массовую долю вещества в полученном растворе.
11. Сколько граммов KCl следует прибавить к 450 г раствора той же соли массовой долей 8% для приготовления раствора с массовой долей 12%?
12. Сколько воды необходимо прибавить к 500 мл раствора NaCl массовой долей 20% (пл. = 1,152 г/мл), чтобы получить раствор с массовой долей 5%?
13. Чему равна молярность раствора, содержащего в 0,75 л 4,41 г поваренной соли?
14. Сколько граммов карбоната натрия необходимо взять для приготовления 155 мл
а) 0,5 М; б) 2 М раствора?
15. Сколько граммов нитрата железа (III) необходимо взять для приготовления 300 мл
а) 0,25 М; б) 3 М раствора?
Пример. Вычислите: а) массовую долю растворенного вещества (ω,%); б) нормальность (СН); в) молярность (СМ); г) моляльность (Cm); д) титр (Т) раствора H3PO4, полученного при растворении 18 г H3PO4 в 282 см3 воды, если относительная плотность полученного раствора составляет 1,031 г/см3.
Дано: mв-ва(H3PO4) = 18 г; V(H2O)= 282 см3; ρ=1,031 г/см3
Найти: СН –? ω –? СМ –? Cm –? Т –?
Решение
а) m (H2O) = V(H2O) = 282 г; m р-ра(H3PO4) = 18 + 282 = 300 г.
Из формулы: ω = m(в-ва) / mр-ра(в-ва) • 100%
ω(H3PO4) = (18 / 300) • 100 = 6%
б) СН = m / (mЭ • V) или СН = m / (М • Э • V)
Масса кислоты в 1 л раствора составит:
m(H3PO4) = 1031 • 18 / 300 = 61,86 г
mЭ(H3PO4) = М(H3PO4) / 3 = 97,99 / 3 = 32,66 г/моль
Cн(H3PO4) = 61,86 / 32,66 = 1,89 моль/л;
в) СМ = ν / V = m / (M • V) СМ(H3PO4) = 61,86 / 97,99 = 0,63 моль/л
г) Сm = m(в-ва) • 1000 / М • m(растворителя)
Сm(H3PO4) = 18 • 1000 / 98 • 282 = 0,65 моль/кг
д) Т = m / V, Т(H3PO4) = 61,86/1000 = 0,06186 г/см3.
Ответ: ω(H3PO4) = 6%; Cн(H3PO4) = 1,89 моль/л; СМ(H3PO4) = 0,63 моль/л; Сm(H3PO4) = 0,65 моль/кг; Т(H3PO4) = 0,06186 г/см3.
Дата публикования: 2014-11-04; Прочитано: 2243 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
