 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Гидролиз солей. Произведение растворимости
|
|
Цель работы: Изучение процесса гидролиза солей различных типов, смещения гидролитического равновесия и определение степени гидролиза солей.
Теория: Основные положения теории электролитической диссоциации. Степень диссоциации электролитов. Сильные и слабые электролиты. Зависимость степени диссоциации от концентрации и природы растворенного вещества и растворителя. Ионное произведение воды. Водородный показатель. Шкала рН. Гидролиз солей в водных растворах. Смещение равновесия гидролиза. Роль гидролиза в биологических и химических процессах. Понятие о буферных системах.
Электролиты – вещества, частично или полностью распадающиеся в растворе (под действие воды или другого растворителя) или расплаве (под действие температуры) на ионы.
NaCl → Na+ + Cl–
Степень диссоциации (α) – отношение числа молекул, распавшихся на ионы (n) к общему числу растворенных молекул (n0).
α = (n/n0) ∙ 100
Процесс электролитической диссоциации характеризуют константой диссоциации (К).
Вода – слабый электролит, но все же обладает небольшой диссоциацией на ионы: H2O ↔ Н+ + ОН–
Константа диссоциации воды равна: Кв = [Н+] ∙ [ОН–] = 10–14 (н.у.), тогда [Н+] = [ОН–] = 10–7 моль/л.
Водородный показатель численно равен отрицательному десятичному логарифму концентрации ионов водорода в этом растворе:
рН = – lg[H+]
Водные растворы имеют значение рН в интервале от 1 до 14. По соотношению концентраций этих ионов различают три типа сред: нейтральную (рН=7), кислую (рН<7) и щелочную (рН>7).
Сильные кислоты: HI, HBr, HCl, HClO4, HClO3, H2SO4, HNO3, HMnO4;
Сильные основания – щелочи: LiOH, NaOH, KOH, CsOH, RbOH, FrOH, Ca(OH)2, Sr(OH)2, Ba(OH)2, Ra(OH)2.
Гидролиз солей – процесс разложения соли водой, сопровождающийся образованием малодиссоциирующих веществ (слабых электролитов – оснований и/или кислот).
Оборудование и реактивы
рН-метр, мерные колбы на 50 мл, мерные пипетки, пробирки, пробиркодержатель, спиртовка, спички, стаканы на 50-100 мл, штатив.
Цинк (гранулы), дистиллированная вода; растворы: соляная кислота HCl (0,1 М), серная кислота H2SO4 (0,1 М и конц.), гидроксид натрия NaOH (0,1 М), хлорид бария BaCl2 (10%), хлорид кальция CaCl2 (10%) и 0,1 М растворы: хлорид алюминия AlCl3, ацетат натрия CH3COONa, карбонат натрия Na2CO3, нитрат натрия NaNO3, хлорид сурьмы SbCl3 (или BiCl3); индикаторы: метиловый оранжевый, универсальная индикаторная бумага, фенолфталеин.
Эксперимент: выполните задания, составьте уравнения реакций, назовите вещества, запишите наблюдения и вывод.
Опыт 1. Определение рН раствора соляной кислоты
 Ознакомьтесь с инструкцией по работе с рН-метром и проведите его калибровку (см. инструкцию по работе рН-метра).
Ознакомьтесь с инструкцией по работе с рН-метром и проведите его калибровку (см. инструкцию по работе рН-метра).
 Приготовьте по 50 мл 0,01 и 0,001 М растворов НСl, используя в качестве исходного 0,1 М раствор. Для этого с помощью мерной пипетки налейте в мерную колбу необходимое количество 0,1 М кислоты, добавьте дистиллированную воду до половины объема колбы и перемешайте раствор. Затем добавьте воды до 3/4 объема колбы, вновь перемешайте. После этого доведите объем раствора до метки и перемешайте его, закрыв колбу пробкой.
Приготовьте по 50 мл 0,01 и 0,001 М растворов НСl, используя в качестве исходного 0,1 М раствор. Для этого с помощью мерной пипетки налейте в мерную колбу необходимое количество 0,1 М кислоты, добавьте дистиллированную воду до половины объема колбы и перемешайте раствор. Затем добавьте воды до 3/4 объема колбы, вновь перемешайте. После этого доведите объем раствора до метки и перемешайте его, закрыв колбу пробкой.
Исходный 0,1 М раствор НСl и приготовленные 0,01 и 0,001 М растворы налейте в стаканчики на 50–100 мл примерно на 1/3–1/2 их объема. Измерьте рН растворов с помощью прибора «ЭКСПЕРТ-001» (рис. 4).
Нажмите и удерживайте в течение 2 сек. кнопку «ВКЛ» на приборе «ЭКСПЕРТ-001». Первая надпись на экране прибора «ЭКСПЕРТ-001» показывает уровень зарядки собственных аккумуляторов преобразователя. Если его величина оказывается менее 30%, необходимо зарядить аккумуляторы при помощи сетевого адаптера.
После появления на экране надписи «Выбор режима. рН-метр-иономер» нажмите на клавиатуре прибора «ЭКСПЕРТ-001» кнопку «ИОН» и кнопками «стрелка влево» (←) или «стрелка вправо» (→) выберите режим «рН». Нажмите кнопку, «ВВОД».
Выньте электрод из буферного раствора, рН = 4,01, в котором он хранится, промойте его дистиллированной водой и осушите фильтровальной бумагой. Опустите подготовленный электрод в исследуемый раствор и нажмите кнопку «ИЗМ» (на дисплее появляется значение ЭДС, а не рН, нажмите кнопку «рХ»). ВНИМАНИЕ! Глубина погружения измерительного электрода в раствор должна быть не менее 25 мм, при этом электрод не должен касаться ни дна, ни стенок стакана. Примерно через минуту запишите показания прибора и нажмите кнопку «ОТМ».
Перед измерением рН следующего раствора ополосните электрод дистиллированной водой и осушите фильтровальной бумагой.
После окончания всех измерений поместите электрод в стаканчик с буферным раствором, имеющим рН 4,01.
Результаты измерения рН 0,1; 0,01 и 0,001 М растворов НСl запишите в таблицу:
| Значение рН | Концентрация раствора HCl, моль/л | ||
| 0,1 | 0,01 | 0,001 | |
| Экспериментальное | |||
| Теоретическое |
Опыт 2. Определение рН раствора гидроксида натрия
Приготовьте по 50 мл 0,01 и 0,001 М растворов NaOH, используя в качестве исходного 0,1 М раствор по методике, описанной в предыдущем опыте. Проведите измерения рН исходного и приготовленных растворов с помощью прибора «ЭКСПЕРТ-001». Результаты опыта занесите в таблицу:
| Значение рН | Концентрация раствора NaOH, моль/л | ||
| 0,1 | 0,01 | 0,001 | |
| Экспериментальное | |||
| Теоретическое |
Опыт 3. Исследование гидролиза солей и распознавание солей слабых и сильных кислот и оснований по значениям рН их растворов
Налейте в четыре стаканчика на 1/3–1/2 объема 0,1 М растворы веществ, приведенных в таблице. Определите рН растворов с помощью рН-метра и универсальной индикаторной бумагой. Укажите: сильная или слабая кислота, сильное или слабое основание образуют соль.
| № пробирки | Формула веществ | Окраска индикатора | Реакция среды | рН раствора | Подвергается ли соль гидролизу | |
| Индикатор | рН-метр | |||||
| Н2О | ||||||
| Na2CO3 | ||||||
| AlCl3 | ||||||
| NaNO3 |
Таким образом, из приведенных солей гидролизу подвергаются:
________________________________________________________________
Составьте уравнения гидролиза этих солей (молекулярные, полные и сокращенные ионные).
Опыт 4. Влияние температуры на гидролиз
В пробирку налейте 2–3 мл 0,5 М раствора CH3COONa и 2–3 капли раствора фенолфталеина. Нагрейте пробирку в пламени спиртовки до кипения. Цвет раствора – _______________. Нагрейте пробирку до кипения в пламени спиртовки. При нагревании наблюдаем ____________________. При дальнейшем охлаждении окраска раствора усиливается _____, ослабевает _____?
Составьте уравнение гидролиза (молекулярное, полное и сокращенное ионные).
Опыт 5. Необратимый (полный) гидролиз
В пробирку к 1–2 мл раствора AlCl3 прилейте 1–2 мл раствора Na2CO3. Наблюдаем: выделение газа ______ и образования осадка ______.
________________________________________________________________
Полученный осадок разделите на две пробирки. В одну пробирку прибавьте разб. HCl, в другую – раствор NaOH. Объясните смешение ионного равновесия в насыщенном растворе амфотерного электролита.
________________________________________________________________
Опыт 6. Сравнительная растворимость сульфатов кальция и бария
В пробирку внесите 5 капель раствора CaCl2, в другую – 5 капель раствора BaCl2. Добавьте в пробирки по 2–3 капли 0,1 М раствора H2SO4. В обеих ли пробирках выпал осадок?
Объяснить наблюдения, используя значения ПР(СаSO4) и ПР(ВаSO4). Прилейте в пробирки по 2–3 капли конц. H2SO4. Объясните образование осадка СаSO4.
Контрольные задания
1. Какие из приведенных ниже солей будут подвергаться гидролизу, написать молекулярные, полные и краткие ионные уравнения (по ступеням), определить реакцию среды и назвать соли: NaBr, NaClO3, NaCN.
2. (см. задание № 1): NH4ClO4, HCOONa, K2S.
3. (см. задание № 1): AlCl3, Na2SiO3, FeSO4.
4. (см. задание № 1): FeCl2, Ca(CN)2, CaCO3.
5. (см. задание № 1): Na2SO3, KNO3, KNO2.
6. (см. задание № 1): NiCl2, Li2SO4, NH4HS.
7. (см. задание № 1): CrCl3, Na2S, Zn(NO3)2.
8. (см. задание № 1): NH4NO2, Mn(ClO4)2, (HCOO)2Ba.
9. (см. задание № 1): Fe2(SO4)3, BaSO3, MnCl2.
10. Приведите выражения констант ступенчатого гидролиз по аниону для Н3РО4. Какая из ступеней гидролиза протекает в наибольшей степени и почему?
11. Сколько граммов гидроксида калия содержится в 10 дм3 раствора, водородный показатель которого равен 11?
12. Укажите реакцию среды и найдите концентрацию [Н+] и [ОН–] в растворах, для которых рН равен: а) 1,6; б) 10,5.
13. Вычислите рН растворов, в которых концентрация ионов [OH–] равна (моль/дм3): a) 4,6 • 10–4; б) 8,1 • 10–6; в) 9,3 • 10–9.
14. Чему равна концентрация раствора уксусной кислоты, рН которой равен 5,2?
15. Вычислите [Н+] и рН раствора H2SO4 с массовой долей кислоты 0,5% (ρ = 1,00 г/см3).
Пример. Вычислите концентрацию ионов [H+] и pH 0,5 М раствора пропионовой кислоты С2Н5СООН. Kдисс.(С2Н5СООН) = 1,4 • 10–5.
Решение
С2Н5СООН – слабая кислота.
Для слабых кислот [Н+] вычисляют по формуле:
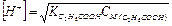 = 2,6 • 10–3
= 2,6 • 10–3
рH = –lg[H+] = –lg(2,6 • 10–3) = 3 – lg2,6 = 2,58
Ответ: [H+] = 2,6 • 10–3 моль/л; pH = 2,58
Дата публикования: 2014-11-04; Прочитано: 1362 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
