 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Некоторых веществ при (298К)
|
|
Таблица 3
| Вещество | ΔН  , кДж/моль , кДж/моль
| S, Дж/(моль*К) |
| Al2O3(к) | -1676 | 50,94 |
| Al2(SO4)3k | -343,78 | 239,1 |
| CO(r) | -110,5 | 197,54 |
| CO2(r) | -393,51 | 213,68 |
| CH4(r) | -74,85 | 186,19 |
| C2H4(r) | 52,28 | 219,4 |
| FeO(к) | -263,8 | 58,79 |
| Fe(к) | 0,00 | 27,15 |
| Fe2O3(к) | -822,16 | 89,96 |
| H2(r) | 0,00 | 130,58 |
| H2O(r) | -241,82 | 188,7 |
| H2O(ж) | -285,84 | 70,08 |
| H2S(r) | -20,17 | 205,6 |
| HNO3(ж) | -174,3 | 156,6 |
| MgO(к) | -601,24 | 26,94 |
| Mg(NO3)2(к) | -789,6 | 164,0 |
| NO(r) | 90,37 | 210,62 |
| NO2(r) | 33,5 | 240,45 |
| O2(r) | 0,00 | 205,00 |
| SO2(r) | -296,9 | 248,1 |
| S(к, ромб) | 0,00 | 31,88 |
| MgCO3(к) | -1096 | 65,1 |
| AlCl3(к) | -704,2 | 109,3 |
| HCl(r) | -92,3 | 186,7 |
| Cl2(r) |
Приложение 4 Стандартные окислительноосстановительные
потенциалы (Т=298К)
Таблица 4
Элемент / Электродный процесс Ео, В
Mn MnO 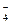 +8H++5ē= Mn2++4H2O 1,510
+8H++5ē= Mn2++4H2O 1,510
MnO 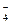 +2H2O+3ē= MnO
+2H2O+3ē= MnO  +4OH- 0,60
+4OH- 0,60
MnO 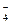 +ē= MnO
+ē= MnO 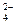 0,56
0,56
O H2O2+2H++2ē= 2H2O 1,78
O2+2H++2ē = H2O2 0,68
Br Br2(ж)+2ē=2Br- 1,07
J J2(k)+2ē=2J- 0,54
Cl Cl2+2ē=2Cl- 1,36
ClO-+H2O
Cr Cr2O  +14H++6ē=2Cr+3+7H2O 1,33
+14H++6ē=2Cr+3+7H2O 1,33
Zn Zn2++2ē=Zn -0,76
N HNO3(p)+9H++8e=NH  +3H2O +0,920
+3H2O +0,920
NO 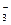 +2H++2ē=NO
+2H++2ē=NO 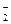 +H2O +0,94
+H2O +0,94
NO 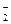 +2H++2e=NO+H2O 1,03
+2H++2e=NO+H2O 1,03
S SO 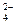 + H2O+2e=SO
+ H2O+2e=SO  +2OH- -0,93
+2OH- -0,93
Fe Fe3++ē=Fe2+ 0,77
P H3PO4+8H++8ē=PH3+4H2O -0,281
H3PO4+2H++2ē=H3PO4+H2O -0,28
Pb Pb2++2ē=Pb -0,13
Учебное издание
Апанович Зинаида Васильевна
МЕТОДИЧЕСКИЕ УКАЗАНИЯ И ЗАДАНИЯ
Дата публикования: 2015-11-01; Прочитано: 281 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
