 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Контрольные задания 71-80
|
|
.Напишите уравнения гидролиза солей, приведенных в вашем задании в молекулярном и ионном виде. Укажите реакцию среды в растворе соли. Напишите выражения для константы и степени гидролиза.
71) бромид цинка, сульфит лития
72) хлорид хрома (III), ортоарсенат калия
73) нитрат свинца (II), гипохлорит кальция
74) фосфат натрия, цианид аммония
75) сульфат меди (II), карбонат цезия
76) перхлорат аммония, силикат натрия
77) сульфат хрома (III), нитрит калия
78) хлорид железа (III), сульфид алюминия
79) ацетат аммония, хлорид железа (II)
80) цианид калия, нитрат цинка
Методические указания:
Гидролизом называется взаимодействие соли с водой, приводящее к образованию слабого электролита и к изменению рН раствора. Соли гидролизуются по ионам слабых электролитов. Различают 3 случая гидролиза 1) по катиону 2) по аниону 3) по катиону и аниону.
ПРИМЕР. Написать гидролиз сульфата меди (II)
 CuSO4 Cu2+ + SO
CuSO4 Cu2+ + SO 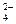
из приложения (приложение 1, таблица 1) выясняем, что иону Cu2+, соответствует слабое основание, а иону SO 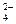 сильная кислота, поэтому гидролиз идет по катиону:
сильная кислота, поэтому гидролиз идет по катиону:
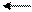
 1) Cu2+ + НОН CuOH+ + H+
1) Cu2+ + НОН CuOH+ + H+
в избытке ионы Н+, что определяет кислую реакцию среды рН < 7

 2) Cu2+ + SO
2) Cu2+ + SO 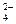 + HOH CuOH+ + H+ + SO
+ HOH CuOH+ + H+ + SO 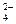

 3) 2Cu SO4 + 2HOH (CuOH)2 SO4 + H 2SO4
3) 2Cu SO4 + 2HOH (CuOH)2 SO4 + H 2SO4
Кв – константа воды
Кк – константа кислоты
Ссоли - молярная концентрация соли;
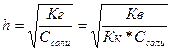 ;
;
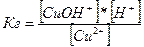 .
.
Дата публикования: 2015-11-01; Прочитано: 525 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
