 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Вопрос 41.Понятия о катализе и катализаторе
|
|
Наиболее мощным способом интенсификации химических процессов является применение катализаторов.
Катализаторы – это вещества, которые ускоряют химические процессы, но при этом не испытывают превращений в ходе реакции. Явление изменения скорости реакции под действием таких веществ называется катализом.
Как правило, катализаторы обладают селективным, т. е. избирательным действием, подбирая вид катализатора, можно изменить ход протекания реакции.
Например, этанол С2Н5ОН в присутствии оксидов алюминия и тория разлагается на этилен С2Н4 и воду:
С2Н5ОН 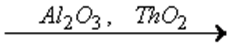 С2Н4 + Н2О,
С2Н4 + Н2О,
в присутствии никеля, железа, серебра или меди – на ацетальдегид СН3СОН и водород:
С2Н5ОН 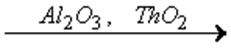
 СН3СОН + Н2.
СН3СОН + Н2.
Сущность действия катализаторов очень сложна и до конца не изучена. Предполагается, что в каталитических процессах снижается энергия активации реакции  (см. рис. 35), так как в присутствии катализатора образуются другие промежуточные активированные комплексы, которые требуют меньшей энергии образования, чем в реакциях, протекающих без катализатора. Многие молекулы исходных веществ, энергия которых была недостаточна для активных столкновений в обычных реакциях, в присутствии катализатора становятся активными. Следовательно,
(см. рис. 35), так как в присутствии катализатора образуются другие промежуточные активированные комплексы, которые требуют меньшей энергии образования, чем в реакциях, протекающих без катализатора. Многие молекулы исходных веществ, энергия которых была недостаточна для активных столкновений в обычных реакциях, в присутствии катализатора становятся активными. Следовательно, 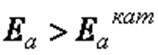 . Катализаторы увеличивают скорость реакции
. Катализаторы увеличивают скорость реакции  , но не влияют на термодинамику процесса, т. е. не изменяют величины
, но не влияют на термодинамику процесса, т. е. не изменяют величины 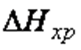 и
и 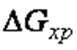 . На активность катализатора влияют промоторы – вещества, при добавлении в небольших количествах которых, эффективность действия катализатора повышается, и каталитические яды – вещества, снижающие каталитическую активность.
. На активность катализатора влияют промоторы – вещества, при добавлении в небольших количествах которых, эффективность действия катализатора повышается, и каталитические яды – вещества, снижающие каталитическую активность.
Различают гомогенный и гетерогенный катализ.
При гомогенном катализе катализатор и реагирующие вещества находятся в одном фазовом состоянии (газ, жидкость).
Пример, промышленное получение серной кислоты.
Реакция окисления: 2H2SO3 + O2 = 2H2SO4 – протекает медленно, она заменяется на быстрые каталитические реакции, где катализатором является NO:
O2 + 2NO = 2NO2, NO2 + H2SO3 = H2SO4 + NO.
Таким образом, гомогенные каталитические реакции протекают через образование промежуточных соединений, в которых участвует катализатор.
Многие природные и физиологические процессы, катализируемые ферментами, протекают по механизму гомогенного катализа: расщепление белков, дегидратация СО2 из крови и т. д.
При гетерогенном катализе катализатор и реагенты находятся в разных фазовых состояниях, чаще всего катализатор – твердое вещество, и реакция протекает на поверхности катализатора. Скорость такой реакции зависит от площади поверхности катализатора, поэтому последний часто наносят на вещества с развитой поверхностью – подложку (пористые угли, силикаты и пр.).
Как и в случае гомогенного катализа, при гетерогенном катализе реакция протекает через образование активных промежуточных соединений, которые представляют собой поверхностные соединениякатализатора с реагирующими веществами. Проходя через ряд стадий (подвод реагентов в зону реакции, адсорбция на поверхности катализатора, собственно химическая реакция, десорбция), в которых участвуют и промежуточные соединения, реакция заканчивается образованием конечных продуктов, а катализатор – не расходуется.
Гетерогенный катализ в промышленности применяется при получении аммиака, азотной и серной кислот, водорода и пр. К наиболее распространенным катализаторам относятся: Pt, Ni, Pd, CuO, V2O5, Al2O3, SiO2 и др. Применение каталитических процессов обеспечивает экономию сырья и энергии, а также решает экологические задачи. Например, катализаторы применяют для доокисления токсичных выхлопных газов в двигателях внутреннего сгорания до нетоксичных компонентов:
CnHm + qO2  nCО2 + m/2Н2О,
nCО2 + m/2Н2О,
2NO + 2CO  N2 +2CO2 + 690 кДж (в качестве катализатора используется металлическая вата из нержавеющей стали или сплавы никеля).
N2 +2CO2 + 690 кДж (в качестве катализатора используется металлическая вата из нержавеющей стали или сплавы никеля).
Дата публикования: 2015-10-09; Прочитано: 550 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
