 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Примеры решения задач. Пример 1. Рассчитайте процентную концентрацию раствора, полученного растворением 100 г вещества в 400 г воды
|
|
Пример 1. Рассчитайте процентную концентрацию раствора, полученного растворением 100 г вещества в 400 г воды.
Решение
Найдем массу раствора:
mР-РА = mВ-ВА + mР-ЛЯ = 100 + 400 = 500 г,
следовательно,
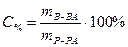 =
=  .
.
Пример 2. Определите объем 0,2 М раствора, содержащего 8 г сульфата меди (II).
Решение
Из формулы молярной концентрации следует, что

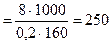 мл.,
мл.,
где - молярная масса сульфата меди (II), 160 г/моль
Пример 3. Сколько граммов нитрата кальция содержится в 200 см3 0,3 н раствора?
Решение
Рассчитаем МЭК Ca(NO3)2. Для соли фактор эквивалентности
 .,
.,
следовательно
 г/моль.
г/моль.
Из формулы

следует, что
 .
.
Подставляем все значения в искомую формулу и получаем:
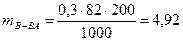 г.
г.
Пример 4. На нейтрализацию 50 см3 раствора кислоты израсходовано 25 см3 0,5 н раствора щелочи. Чему равна нормальность кислоты?
Решение
Так как вещества взаимодействуют между собой в эквивалентных соотношениях, то растворы равной нормальности реагируют в равных объемах. При разных нормальностях объемы растворов реагирующих веществ обратно пропорциональны их нормальностям, т.е.


или
CН(1) · VР-РА(1) = CН(2) · VР-РА(2).; 50 . C  = 25 . 0,5
= 25 . 0,5 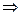 C
C  =
= 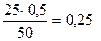 н.
н.
Пример 5. Определите моляльность 8 процентного раствора гидроксида натрия.
Решение.
Моляльность выражается числом молей растворенного вещества в 1000 г растворителя:
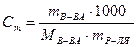 .
.
Поскольку соотношение между веществом и растворителем для заданного раствора не зависит от его массы, то необходимые для решения данные вводим в условие задачи. Пусть масса раствора равна 100 г. Тогда из определения процентной концентрации, следует, что в 100 г 8 процентного раствора содержится 8 г вещества и 100 – 8 = 92 г растворителя. Молярная масса NaOH равна 40 г/моль, тогда
 моль/кг.
моль/кг.
Пример 6. Найдите молярную долю глюкозы (С6Н12О6) в 36 процентном водном растворе.
Решение
Пусть масса раствора равна 100 г. Тогда масса глюкозы в этом растворе равна 36 г, а масса воды 100 – 36 = 64 г;  г/моль;
г/моль;  г/моль, тогда
г/моль, тогда
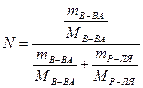 =
= 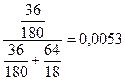 или 0,53 %.
или 0,53 %.
Пример 7. Титр раствора гидроксида калия равен 0,0028 г/моль. В каком объеме раствора содержится 0,56 г гидроксида калия?
Решение
Из формулы

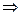
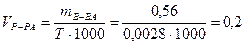 л.
л.
Пример 8. К 1 л 10 процентного раствора КОН (плотность 1,092 г/см3) прибавили 0,5 л 5 процентного раствора КОН (плотность 1,045 г/см3). Объем смеси довели до 2 л. Вычислите молярную концентрацию полученного раствора.
Решение
Масса 1 л 10 процентного раствора КОН равна
mР-РА = ρР-РА ·VР-РА . 1000 = 1,092 . 1 . 1000 = 1092 г.
В этом растворе содержится
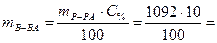 109,2 г КОН.
109,2 г КОН.
Масса 0,5 л 5 процентного раствора КОН
mР-РА = ρР-РА ·VР-РА . 1000 = 1,045 . 0,5 . 1000 = 522,5 г.
В этом растворе содержится
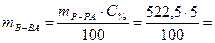 26,125 г КОН.
26,125 г КОН.
В полученном растворе (2 л) содержится 109,2 + 26,125 = 135,325 г КОН.
Отсюда молярность этого раствора равна:
 =
=  М,
М,
где молярная масса КОН, 56 г/моль.
Пример 9. Какой объем 96 процентной серной кислоты плотностью 1,84 г/см3 потребуется для приготовления 3 л 0,4 н раствора?
Решение
Молярная масса эквивалента
Мэк (H2SO4) =  г/моль.
г/моль.
Для приготовления 3 л 0,4 н раствора требуется
 0,4 . 49 . 3 = 58,8 г H2SO4.
0,4 . 49 . 3 = 58,8 г H2SO4.
Масса 1см3 96 процентной Н2SО4 равна 1,84 г. В этом растворе содержится
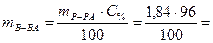 1,766 г Н2SO4.
1,766 г Н2SO4.
Следовательно, для приготовления 3 л 0,4 н раствора надо взять 58,8: 1,766 = 33,3 см3 раствора этой кислоты.
Дата публикования: 2015-10-09; Прочитано: 1976 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
