 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Способы выражения состава растворов
|
|
Концентрацией раствора называется отношение количества или массы вещества, содержащегося в растворе, к определенной массе или определенному объему раствора или растворителя.
Введем обозначения:
mВ-ВА – масса растворенного вещества, г (в СИ – кг). Здесь и далее указаны размерности величин, которые наиболее часто встречаются при химических расчетах. Жирным шрифтом выделены наиболее часто используемые размерности;
mР-РА – масса раствора, г, кг;
mР-ЛЯ – масса растворителя, г, кг;
VР-РА – объем раствора, мл, л (или соответственно: см3, дм3);
VР-ЛЯ – объем растворителя, мл, л (соответственно: см3, дм3);
ρР-РА – плотность раствора, г/мл, кг/л (соответственно: г/см3, кг/дм3);
ρР-ЛЯ – плотность растворителя, г/мл, кг/л (соответственно: г/см3, кг/дм3);
MВ-ВА – молярная масса растворенного вещества, г/моль;
MР-ЛЯ – молярная масса растворителя, г/моль;
MЭК – молярная масса эквивалентов растворенного вещества, г/моль;
nВ-ВА – количество растворенного вещества, моль;
nЭК – количество эквивалентов вещества, моль;
nР-ЛЯ – количество растворителя, моль.
Взаимный пересчет параметров раствора, растворителя и растворенного вещества проводят с учетом следующих соотношений (для двухкомпонентного раствора: одно вещество и растворитель, если веществ несколько, то необходимо учитывать массы всех веществ);
mР-РА = mВ-ВА + mР-ЛЯ
mР-РА = ρР-РА · VР-РА; mР-ЛЯ = ρР-ЛЯ · VР-ЛЯ;
 ;
;  ;
;  ;
;
VР-РА(2) ≠ VР-РА(1) + VР-ЛЯ; VР-РА(3) ≠ VР-РА(1) + VР-РА(2).
Приведем наиболее часто употребляемые в химии способы выражения содержания растворенного вещества в растворе. В нижеприведенных формулах объемы взяты в литрах, массы – в граммах. При использовании указанных формул для решения задач, в условиях которых объемы и массы взяты в других единицах измерения, их предварительно пересчитывают.
Массовая доля ω – безразмерная величина, равная отношению массы компонента в растворе к массе всего раствора (размерности масс одинаковы):
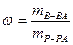 .
.
Массовая доля выражается обычно в процентах – процентная концентрация С% - и показывает, сколько граммов компонента содержится в 100 г раствора:


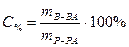 .
.
Массовая доля, кроме долей единицы и процентов (получены умножением на 100), может быть также выражена в промилле (0/00 – умножение на 1000), в частях на миллион (ppm – умножение на 106) и в частях на миллиард (ppb – умножение на 109).
Молярная концентрация См - отношение количества вещества, содержащегося в растворе, к объему раствора, моль/м3. На практике молярную концентрацию выражают обычно в дольных производных единицы объема: моль/дм3 или моль/л (сокращенное обозначение молярной концентрации в задачах – М, например: 2М – двумолярный раствор, т. е. СМ = 2 моль/л):
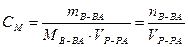 .
.
Молярная концентрация эквивалентов (эквивалентная СЭК , или нормальная концентрация СН) - это отношение количества эквивалентов вещества, содержащегося в растворе, к объему этого раствора, моль/м3 или моль/дм3, моль/л (сокращенное обозначение - н):
 .
.
Молярные массы эквивалентов веществ рассчитываются по формуле
MЭК = fЭК · MВ-ВА,
где fЭК – фактор эквивалентности:
- для кислоты
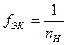 ,
,
где nH - основность кислоты;
- для основания
 ,
,
где nOH – кислотность основания;
- для соли
 ,
,
где n – число атомов металла в формульной единице соли;
B – валентность металла.
Для растворов с нормальной концентрацией справедлива формула, которая вытекает из закона эквивалентов:
nЭК(1) = nЭК(2),
следовательно,
CН(1) · VР-РА(1) = CН(2) · VР-РА(2).
Моляльность Сm – определяется количеством вещества в 1 кг (1000 г) растворителя, моль/кг:
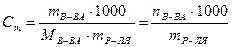 .
.
Молярная (мольная) доля растворенного вещества N - отношение количества растворенного вещества к общему количеству всех вещества, составляющих раствор, включая растворитель:
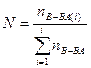 .
.
Молярная доля может быть выражена в долях единицы, в процентах (%), в промилле (0/00), в частях на миллион (ppm) и в частях на миллиард (ppb).
Сумма мольных долей всех компонентов раствора равна единице.
В случае двухкомпонентного раствора:
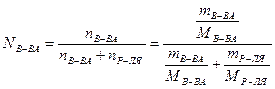 .
.
Титр раствора (СТ или Т) - масса вещества, содержащаяся в одном миллилитре раствора (г/мл или г/см3):
 .
.
Массовые концентрации (массовая доля, процентная, моляльная) не зависят от температуры; объемные концентрации относятся к определенной температуре.
Дата публикования: 2015-10-09; Прочитано: 429 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
