 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Анализ процесса в химическом реакторе
|
|
Анализ процесса в химическом реакторе исследования влияния условий процесса и характеристик(свойств) его составляющих на показатели работы реактора, а также выявление особенностей процесса и режима.
Условия процесса – состав исходной реакционной смеси (исходные концентрации реагентов 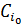 ), объем поступающего потока (нагрузка на реактор
), объем поступающего потока (нагрузка на реактор 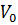 ), температуры входного потока
), температуры входного потока 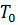 , хладагента
, хладагента  (для процессов с теплоотводом) или в реакторе (для процессов с теплоотводом) или в реакторе (для изотермического процесса –
(для процессов с теплоотводом) или в реакторе (для процессов с теплоотводом) или в реакторе (для изотермического процесса – 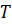 ).
).
Режимы процесса – характеристики химического процесса, схема превращения и тип реакций(вид кинетических уравнений), энергия активации, тепловой эффект; для неизотермических процессов – параметры теплоотвода (коэффициенты теплопередачи 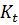 , величина поверхности теплообмена
, величина поверхности теплообмена 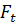 , теплофизические свойства потока
, теплофизические свойства потока 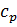 ).
).
Показатели процесса – степень превращения x, селективность – S, выход продукта E, а также профили концентраций, степени превращения и температуры в реакторе, их изменение во времени. Зная эти показатели, можно далее определять и другие: конструктивные параметры реактора, энергетические затраты, экономические показатели и др.
Особенности процесса и режима – влияние условий и свойств процесса на его показатели, управление процессом (изменение условий и свойств для достижения желательных показателей); критические режимы (например, их существование, неустойчивость).
Анализ процесса в химическом реакторе осуществляют с использованием методов математического моделирования.
Один из вариантов последовательности проводимого анализа рассмотрим ниже.
1. Обоснование и построение математической модели процесса.
2. Преобразование уравнений математической модели к виду, удобному для дальнейшего исследования.
3. Решение уравнений математической модели для получения зависимостей, подлежащих анализу.
4. Представление результатов решения уравнений в графическом виде, как наиболее удобном для анализа.
5. Интерпретация результатов решения уравнений на процесс в исследуемом реакторе, то есть перенос полученных зависимостей между переменными уравнений на состояние процесса в реакторе.
6. Собственно анализ модели и процесса: выявление свойств математической модели на основе поведение (изменения) решения при изменении параметров уравнений и перенос свойств модели на процесс в реакторе.
7. Сопоставление процессов в реакторах различного типа.
8. Выявление особенностей математической модели и, следовательно, особенностей режима.
61. ИЗОТЕРМИЧЕСКИЙ ПРОЦЕСС В ХИМИЧЕСКОМ РЕАКТОРЕ. РЕЖИМ ИДЕАЛЬНОГО СМЕШЕНИЯ И ИДЕАЛЬНОГО ВЫТЕСНЕНИЯ. ПРОСТАЯ НЕОБРАТИМАЯ РЕАКЦИЯ А=R.
Математическая модель процессов
 =w (c); c = c0 при
=w (c); c = c0 при 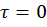 (1)
(1)
Где 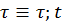 в зависимости от процесса
в зависимости от процесса
Математическая модель для реакции первого порядка: (т.к. w(c) = -RC): (2)
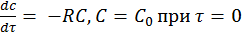 (3)
(3)
Интегрируя (3) получил:
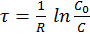 и С
и С 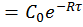 (4)
(4)
Выражая концентрацию через степень превращения [ 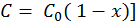 , получим из (3):
, получим из (3): 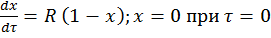 (5)
(5)
И его решением будет
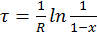 и
и 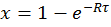 (6)
(6)
Графики С ( на рисунке
на рисунке
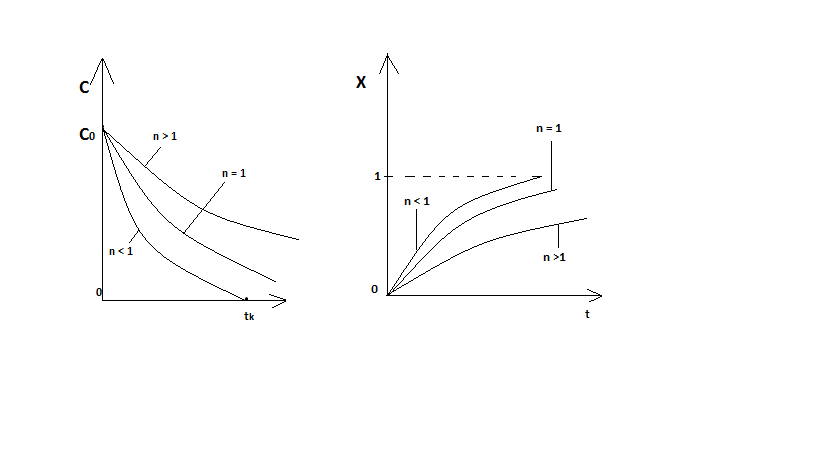
Из графиков видно, что при 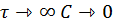 или x
или x  соответственно, следовательно, в необратимой реакции исходное вещество постепенно расходуется до его полного превращения.
соответственно, следовательно, в необратимой реакции исходное вещество постепенно расходуется до его полного превращения.
Интерпретация решения (4) уравнений математической модели (1) на процессы в режимах ИС - п и ИВ следующая.
В режиме ИС – п процесс не стационарен 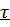 ≡ t и со временем t концентрация исходного вещества C уменьшается в соответствии с (4).
≡ t и со временем t концентрация исходного вещества C уменьшается в соответствии с (4).
Но в каждый момент времени – концентрация C во всех точках реактора одинакова.
В режиме ИВ процесс протекает стационарно. Концентрация C меняется по длине 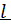 реактора
реактора 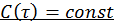 .
.
То анализ зависимостей С 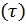 (4) или
(4) или 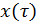 (6) показывает влияние условий процесса на изменение концентрации С, или степени превращения x во времени в режиме ИС – п и распределение C и x по длине реактора в режиме ИВ.
(6) показывает влияние условий процесса на изменение концентрации С, или степени превращения x во времени в режиме ИС – п и распределение C и x по длине реактора в режиме ИВ.
62.Изотермический процесс в химическом реакторе. Режим идеального смешения периодического и идеального вытеснения. Простая обратимая реакция А↔ R
Математическая модель процессов:
dc/d ῖ =W (с);с=с0,при ῖ =0 (1)
Где ῖ= ῖ; t в зависимости от процесса.
Скорость реакции r(c)=k1cA-k2cB зависит от концентраций сА и сВ, следовательно для описания процесса используют два уравнения вида (1).
Перейдем к одной переменной – степени превращения х реагента А: сА=с0(1-х) и cR=c0x,где с0-исходная концентрация реагента А.
Модель процесс примет вид:
dx/dῖ=k1(1-x)-k2x; х=0,при ῖ =0 (2)
Преобразуем (2) к виду dx/dῖ=k1 -(k1+k2)x и проинтегрируем его:
 ln k1-(k1+k2)x-ln k1/k1+k2=ῖ, или х =k1/k1+k2 [1-e-(k1+k2) ῖ ] (3)
ln k1-(k1+k2)x-ln k1/k1+k2=ῖ, или х =k1/k1+k2 [1-e-(k1+k2) ῖ ] (3)
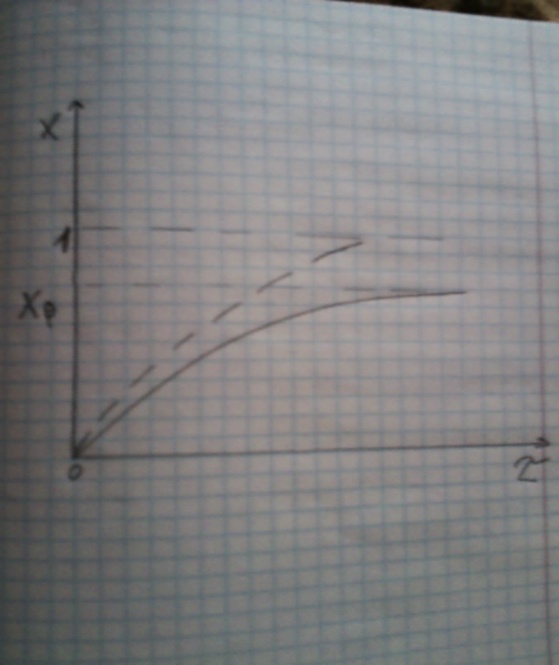
Из (3) видно,что с увеличением ῖ х(ῖ) увеличивается вплоть до х=k1/k1+k2 при ῖ→∞.
Т.к.константа равновесия обратимой реакции Kр=k1/k2 и равновесная степень превращения xр =Kр/1+Kр, то предельное превращение достигаемое в реакторе равно:
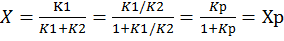 (4)
(4)
Это естественно,т.к реакция протекает до равновесия.Зависимость х(ῖ) для простой обратимой реакции (сплошная линия) и обратимой реакции (штриховая линия) представлена на рисунке.
Рассматриваемая реакция имеет первый порядок в прямом и обратном направлении,поэтому начальная концентрация с0 не влияет на степень превращения.
Дата публикования: 2015-10-09; Прочитано: 946 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
