 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Основные факторы, влияющие на гетерогенные и католитические процессы
|
|
1. Влияние массопередачи в порах.
Каталитическая рекция протекает в основном на пов-ти пор катализатора,т.к внутренняя пов-ть катализатора на несколько пор больше внешней. Поэтому условия транспорта реагентов в поры оказывают существенное влияние на протекание реакции.
Если диффузия в порах катализатора протекает быстрее реакция то вся доступная поверхность катализатора принимает участие в реакции. Наблюдается установившийся диффузионный поток, перемещающий молекулы внутрь частиц катализатора и выводящий из них образующиеся молекулы.
Для "медленных" химических реакций полезной оказывается практически вся внутренняя поверхность катализатора, в случае "быстрых" реакций вещества превращаются в конечные продукты еще до того, как проникают в глубь, т.е. реакция протекает почти целиком на внешней поверхности катализатора.
2. Эффективность использования внутренней поверхности катализатора. Эффективность использования поверхности катализатора зависит от условий проведения процесса - t-ры, давления и т.д., влияющих на константу скорости реакции и коэффициент диффузии. Количественно эффективность использования поверхности катализатора оценивают коэффициентом эффективности E- отношением средней скорости расходования реагента в порах катализатора к максимальной скорости расходования, которая имела бы место в отсутствие тормозящего влияния внутренней диффузии.
3. Стадия адсорбции.
При физической адсорбции равновесие между адсорбированными частицами и частицами в газовой фазе устанавливается быстро. Физ.адсорбция вызывается теми же силами межмолекулярного взаимодействия,что и конденсация паров. Эти силы неспецифичны. Теплота физ. адсорбции =10-40кДж\моль.
Физ.адсорбция играет существенную роль тогда, когда t-ра 2 раза ниже критической, т.е.когда газ становится паром.
хемосорбция отличается от физ.адсорбции значительно большей специфичностью,т.е.зависимостью от природы адсорбента и адсорбата. Теплота хемосорбции близка к теплоте хим.реакции. В этом случае десорбция может сопровождаться хим.реакциями, хемосорбция протекает сравнительно медленно, со скоростью определяемой наличием активационного барьера(активированная адсорбция)Процесс хемосорбции состоит из 2 стадий: 1 )быстрая физическая адсорбция; 2) медленная хим.реакция с поверхностью твердого тела.
При низких t-рах скорость хемосорбции мала и наблюдается только физ.адсорбция. При высоких t-рах физ.адсорбция почти незаметно и происходит лишь хемосорбция. Скорость гетероенно-каталитической реакций пропорционально поверхности концнтрациям адсорбированных малекул. О поверхностных концентрациях реагентов можно судить по равновесному распределению молекул адсорбата между поверхностью твердого тела и газовой фазой. Равновесное распределение оценивают по изотерме адсорбции, показывающий, каким образом адсорбированного вещества зависит от равновесного парциального давления данного газапри постоянной t-ре.
4. влияние характера адсорбции на кинетику гетерогенного катализа. Для расчета каталитического реактора необходимо иметь конкретный вид кинетического уравнения,т.е.зависимость скорости процесса от концентрации реагентов, t-ры и т.д. Скорость каталитической реакции зависит от поверхностных концентраций адсорбированных частиц. На практике известны не поверхностные, а объемные концентрации компонентов в газовой фазе или их прациальное давление. Поэтому кинетические уравнения гетероенно-каталитических реакций представляют в виде зависимости скорости от концентраций реагентов в газовой фазе(или парциальных давлений)
51. Тепловые явления в хим.процессе: гетерогенный процесса поверхности раздела фаз.
До сих пор предметом рассмотрения являлись изотермические процессы (Т=const во всем объеме реактора).
Химические реакции сопровождаются выделением или поглощением тепла.
Это приводит к изменению температуры в месте протекания реакции и, соответственно к изменению скорости превращения.
В гетерогенном химическом процессе тепловой эффект реакции приводит к возникновению градиента температуры и явлений переноса в месте протекания реакции. Рассмотрим случаи наиболее значимого влияния тепловых явлений на протекание химического процесса.
Гетерогенный процесс на поверхности раздела фаз. Рассмотрим гетерогенные процессы, протекающие в системах «газ – полностью реагирующие твердые» (модель «сжимающаяся сфера») на непористом зерне катализатора, имеющие разные механизмы и одинаковые стадии взаимодействия газообразного компонента с поверхностью твердой частицы. Через пограничный слой у поверхности твердой частицы происходит не только массоперенос, но и отвод (подвод) теплоты, основные параметры которого – коэффициент теплопередачи между поверхностью зерна и потоком – α 3 и скоростью теплообмена - α 3 (Tn – T0), где Tn,T0 – температура на поверхности и в объеме частицы, и потока соответственно. Скорость тепловыделения, вследствие протекания реакции на поверхности равна – Qpr(Cn, Tn), где Qp – тепловой эффект реакции, r – ее скорость, Сn – концентрация газообразного реагента у поверхности частиц.
В стационарном режиме. α 3 (Tn – T0) = Qpr(Cn, Tn) (1)
Математическая модель реакционного взаимодействия газа с поверхностью частицы описывается уравнением: - β3 (С0 – Сn) = W(Cn), (2)
Где β3 – коэффициент мАссообмена у поверхности зерна (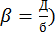
С0 – концентрация газообразного реагента в потоке.
W(Cn)= W2 – скорость превращения газообразного реагента на единице поверхности твердой частицы. - β3 (С0 – Сn) = W1 – поток газообразного реагента к единице поверхности частицы: т.к. в стационарном режиме W1=W2 то отсюда получаем выражение (2). Использую взаимосвязь скорости превращения вещества W и скорости реакции r: W(C,T) = -r(C,T), (3)
Запишем уравнение (2) для взаимодействия вещества с поверхностью в виде:
β3 (С0 – Сn) = r (Cn,Tn) (4) Выражение (1) и (4) – математическая модель процесса с учетом тепловыделения реакции. Разделив уравнение (1) на (4) получим соотношение между разогревом поверхности (Tn – T0) и превращением на ней исходного компонента (С0 – Сn): α 3 (Tn – T0) =Qp β3 (С0 – Сn), (5)
где Сn и С0 – концентрация исходного газообразного компонента на поверхности и в объеме соответственно.
Механизм массо- и теплообмена между поверхностью и потоком одинаковы – это молекулярный перенос через пограничный слой с помощью диффузии и теплопроводности. Отсюда, использую теорию подобия, можно показать, что между коэффициентом массообмена у поверхности зерна β 3 и коэффициентом теплопередачи между поверхностью зерна и потоком α 3 существует соотношение: β 3 = α 3 / Ср, (6) где Ср – теплоемкость газа при р=const.
Концентрацию вещества на поверхности зерна выразим через степень его превращения: xn=  , или (С0 – Сn)= xn С0.
, или (С0 – Сn)= xn С0.
Используя соотношение (6) и последнее выражение (С0 – Сn)= xn С0 уравнение (5) приведет к виду:
Tn – T0 =  xn (7) Входящее в это уравнение Qp – выделившаяся при превращении единици качества исходного реагента, а произведение Qp·C0=qp – теплота, которая выделилась в единице количества реакционной смеси, содержащего С0 этого реагента. Чтобы данную реакционную смесь нагреть на ∆Т градусов надо qT=∆TСр теплоты. В случае адиабатического процесса (когда qp=qT), смесь разогреется на ∆Tад=
xn (7) Входящее в это уравнение Qp – выделившаяся при превращении единици качества исходного реагента, а произведение Qp·C0=qp – теплота, которая выделилась в единице количества реакционной смеси, содержащего С0 этого реагента. Чтобы данную реакционную смесь нагреть на ∆Т градусов надо qT=∆TСр теплоты. В случае адиабатического процесса (когда qp=qT), смесь разогреется на ∆Tад= 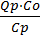 , градусов.
, градусов.
Эта величина в технологии называется адиабатическим разогревом: ∆Tад= 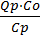 , (8)
, (8)
Адиабатический разогрев определяет изменение температуры реакционной смеси в ходе протекания реакции адиабатически до конца.
Величина ∆Tад – важная характеристика химического процесса, её характерная величина для промышленных реакторов несколько сотен градусов.
Подставив в уравнение (7) уравнение (8) получим Tn –T0 = ∆Tад·xn (9)
Это уравнение показывает изменение температуры поверхности твердой частицы, равное адиабатическому разогреву при установившейся степени превращения вещества на поверхности xn. Если протекает эндотермическая реакция (Qp<0), температура поверхности Tn будет меньше температуры реакционной смеси, то есть Tn-T0<0.
52. Критические тепловые явления в гетерогенном процессе: неоднозначность стационарных режимов;
Допустим протекает реакция первого порядка r(C,T)=k(T)C.
Используя выражение для стенки превращенияна поверхности: xn=(C0-Cn)/C0,
Связь коэффициентов массо- и теплообмена (6) β 3 = α 3 / Ср и определении адиабатического разогрева (8) ∆Tад=  , преобразуем уравнение (4) и (5) к виду:
, преобразуем уравнение (4) и (5) к виду:
xn= 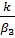 (1-xn) (10)
(1-xn) (10)
β3(С0-Сn)=r(Сn, Tn) (4) но r(Cn, Tn)=k(T)Cn=>β3(C0 – Cn)=kCn=> 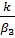 =
=  но x=
но x= 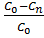 =>x=1-
=>x=1-  =>
=> 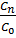 =1-x, а
=1-x, а 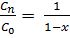 но и
но и 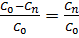 – 1 =>
– 1 =>  - 1 =
- 1 =  =
= 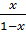 ; т.о.
; т.о.  =
= 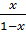 и получим:
и получим:  => (10) и,
=> (10) и,
Tn – T0 = ∆Tад· xn (11)
α3 (Tn-T0)=Qpβ3 (C0-Cn), (5)
∆Tад =  ; x=
; x=  β3=
β3=  => β3Cp(Tn-T0) = Qpβ3C0
=> β3Cp(Tn-T0) = Qpβ3C0  => Tp-T0=
=> Tp-T0=  , xn => Tn – T0=∆Tад·xn из (10) выразим xn
, xn => Tn – T0=∆Tад·xn из (10) выразим xn
Xn=  , (12)
, (12)
Подставим (12) в (11) получим:
Tn – T0 = ∆Tад  (13)
(13)
Количество отводимой от поверхности теплоты равно α3 (Tn-T0) (см. (1)), т.о. левая часть уравнения (13) представляею теплоотвод, который обозначим qp.
Экспоненциальная зависимость k(Tn) = k0 exp( - 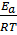 не позволяет из уравнения (13) получить значение Tn в явном виде.
не позволяет из уравнения (13) получить значение Tn в явном виде.
Используем графический метод решения уравнения.
На рисунке 1 даны зависимости теплот выделения qp и qT от температуры Tn на поверхности для процесса взаимодействия газа с твердой частицей.
| Рисунок 1. Зависимость теплот выделения qp и qT от температуры на поверхности Tn для процесса взаимодействия газа и твердой частицы. Точки пересечения 1,2,3 соответствуют разным стационарным режимам. |
Пересечение кривых на графике зависимостей qT(Tn) и qp(Tn),будет решением уравнения (13). Зависимость qp(Tn) имеет вид S – образной кривой.
При малых значениях температур, когда k/β3<<1, qp(Tn) ~∆Tад ·  , - функция принимает вид, подобный экспоненциальной функции. При больших значениях температур, когда k/β3 >>1, qp ~ ∆Tад и зависимость – прямая линия.
, - функция принимает вид, подобный экспоненциальной функции. При больших значениях температур, когда k/β3 >>1, qp ~ ∆Tад и зависимость – прямая линия.
Из рисунка 1 видно, что в зависимости от значения T0 (температуры в объеме) возможно одно или три пересечения зависимостей qT (Tn) c qp(Tn), то есть одно или три решения уравнения (13).
Наличие трех решений указывает на то, что при одних и тех же условиях процесса возможны один или три стационарных режима, то есть существует неоднозначность стационарных режимов. Какой из них будет реализован зависит от предыстории процесса. Если в начале твердая частица имеет температуру Tон, близкую к температуре газа T0 то будет реализован низкотемпературный режим (точка 1 на рис.1). При этом температура и концентрация в потоке (T0 и C0) и на поверхности частицы (Tn и Cn) близки друг к другу – режим кинетический. Если же вначале частица была разогрета до TOB, то установится высокотемпературный режим (точка 3 на рис. 1) с разогревом поверхности, близким к адиабатическому (см. уравнение (9)), то есть Cn<<C0 и режим – внешнедиффузионный.
Таким образом, можно выделить области существования стационарных режимов в рассматриваемом процессе. Низкотемпературные режимы существуют при T0<T0Н, высокотемпературные при T0>T0B. При T0<T0B и T0>T0Н –стационарный режим единственный. Если же T0 лежит в интервале T0B< T0<T0Н, то система будет находиться в одном из трех стационарных режимов.
Необходимо отметить, что при некоторых условиях процесса уравнение (13) будет иметь один корень, то есть при всех T0 будет существовать единственный стационарный режим (см. зависимость q’p(Tn) рис. 1)
Дата публикования: 2015-10-09; Прочитано: 1269 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
