 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Технологические характеристики твердых катализаторов
|
|
Катализаторы очень специфичны по отношению к различным химическим реакциям. Эту специфичность объясняют рядом энергетических и геометрических факторов, в результате влияния которых данный катализатор воздействует на скорость только одной реакции или очень узкой группы реакций. Твердые катализаторы - высокопористые вещества с развитой внутренней поверхностью, характеризующихся определенной пористой и кристаллической структурой, активностью, селективностью и рядом других технологических характеристик.
Некоторые характеристики твердых катализаторов.
1) Активность - мера ускоряющего воздействия по отношению к данной реакции. Количественным критерием активности катализатора может служить константа скорости данной реакции, измеренная для разных катализаторов в сопоставляемых условиях (например, стандартных).
Катализаторы сравнивают по скорости реакции, по степени превращения реагентов, по количеству реагентов, вступающих во взаимодействие в единицу времени на единице поверхности катализатора (по производительности или напряженности катализатора) и т.п.Если каталитическая реакция имеет такой же порядок что и некаталитическая, то есть их константа скорости k` и k - имеют одинаковые единицы измерения, то активность А катализатора можно определить, как отношение констант:
L ECuCbO91HfvQM6mmPVJW+qxjkG4qgR+rMdYqjSoHXStTn1BZMFNn4yTipjPwk5IBu7qkGseOEvVR Y23ydLkMQxCNZbZeoAHXnurawzRHoJJ6Sqbtzk+Dc7Ag2w7fSScx7B3Wcy+j1C+czuyxb2MFzjMW BuPajlEvf4LtLwAAAP//AwBQSwMEFAAGAAgAAAAhAIZw3ZfcAAAACAEAAA8AAABkcnMvZG93bnJl di54bWxMj8FOwzAQRO9I/IO1lbhRpw4qaYhTQSU49NaCBEc3XuKo8TqK3Tb8fZcTHFfzNPO2Wk++ F2ccYxdIw2KegUBqgu2o1fDx/npfgIjJkDV9INTwgxHW9e1NZUobLrTD8z61gksolkaDS2kopYyN Q2/iPAxInH2H0ZvE59hKO5oLl/teqixbSm864gVnBtw4bI77k+eRxWBXMdiis58F+c325evN7bS+ m03PTyASTukPhl99VoeanQ7hRDaKXoN6VExqyHMQHKvVwxLEgTmVFyDrSv5/oL4CAAD//wMAUEsB Ai0AFAAGAAgAAAAhALaDOJL+AAAA4QEAABMAAAAAAAAAAAAAAAAAAAAAAFtDb250ZW50X1R5cGVz XS54bWxQSwECLQAUAAYACAAAACEAOP0h/9YAAACUAQAACwAAAAAAAAAAAAAAAAAvAQAAX3JlbHMv LnJlbHNQSwECLQAUAAYACAAAACEA9DcLkSsCAABRBAAADgAAAAAAAAAAAAAAAAAuAgAAZHJzL2Uy b0RvYy54bWxQSwECLQAUAAYACAAAACEAhnDdl9wAAAAIAQAADwAAAAAAAAAAAAAAAACFBAAAZHJz L2Rvd25yZXYueG1sUEsFBgAAAAAEAAQA8wAAAI4FAAAAAA== ">
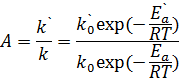
|
(3),
где  и
и 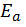 – энергии активации каталитической и некаталитической реакций соответственно. Из уравнения(3) следует, что активность тем выше, чем больше снижается энергия активации в присутствии катализатора.
– энергии активации каталитической и некаталитической реакций соответственно. Из уравнения(3) следует, что активность тем выше, чем больше снижается энергия активации в присутствии катализатора.
2) Температура зажигания Тзаж – это минимальная температура, при которой технологический процесс начинает идти с достаточной для практических целей скоростью. Для экзотермических реакций понятие «температура зажигания» можно определить количественно. Чем меньше температура проведения процесса, тем меньше скорость реакции и тем меньше выделяется теплоты. При некоторой минимальной температуре (температуре зажигания) скорость выделения теплоты становится равной скорости отвода теплоты (расход тепла на нагрев исходной реакционной смеси и выносу теплоты с продуктами реакции).
3) Селективностью катализатора называют его способность избирательно ускорять целевую реакцию при наличии нескольких побочных. Количественно селективность катализатора можно оценить как селективность процесса - интегральную SR или дифференциальную 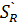 . Дифференциальная селективность по R – отношение скорости превращения исходного вещества в определенный продукт к общей скорости его превращения.
. Дифференциальная селективность по R – отношение скорости превращения исходного вещества в определенный продукт к общей скорости его превращения.
А R 
S
последовательная схема А R S 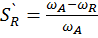
Интегральная селективность: 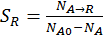 ,
,
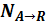 - количество А превратившегося в R
- количество А превратившегося в R
 - исходное количество А
- исходное количество А
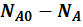 - общее количество А превратившегося при реакции.
- общее количество А превратившегося при реакции.
Селективность зависит не только от выбранного катализатора, но и от условий проведения процесса, от области протекания гетерогенно-каталитического процесса (кинетической, диффузионной) и т.д.
4) Пористая и кристаллическая структура катализатора
Важным свойством катализатора является пористая структура, которая характеризуется размерами и формой пор, пористостью (отношением свободного объема пор к общему объему), удельной поверхностью катализатора (то есть приходящейся на единицу массы или объема). Важную роль играет доступность поверхности катализатора для реагирующих газов. Чем больше для каждого данного катализатора поверхность, доступная для реагирующего газа, тем выше скорость расходования реагентов в единицу времени при использовании того же количества катализатора. Скорость превращения реагентов в конечные продукты может уменьшаться вследствие затруднения диффузии внутри пор. Большое значение имеет кристаллическая структура катализаторов. Различные кристаллические модификации одного и того же вещества могут обладать сильно отличающейся каталитической активностью
5) Промотирование и отравление катализаторов.
Часто введение очень небольшого количества (долей процента) какой-либо посторонней добавки к основному катализатору приводит либо к резкому повышению его активности, либо, наоборот, к снижению активности на несколько порядков. Практическому использованию каталитических процессов часто препятствует снижение активности катализатора при воздействии на него веществ, называемых каталитическими ядами. Каталитические яды блокируют активные центры, образуя с ними поверхностные химические соединения.Отравление бывает обратимым и необратимым. При обратимом отравлении активность катализатора постепенно восстанавливается. При необратимом отравлении активность восстановить не удается. С целью удлинения срока службы катализатора предусматривают тщательную очистку реагирующих веществ от примесей, являющихся каталитическими ядами. В ряде случаев катализатор отравляется побочными продуктами реакции.
49. Основные стадии и кинетические особенности гетерогенно-каталитических процессов.
Гетерогенно-каталитическая реакция на поверхности твердого катализатора - это сложный многостадийный процесс.
Наблюдаемая общая скорость каталитической реакции зависит от относительных скоростей нескольких различных по своей физической и химической природе стадий.
На рисунке дана схема и структура гетерогенно-каталитического процесса:
Пс
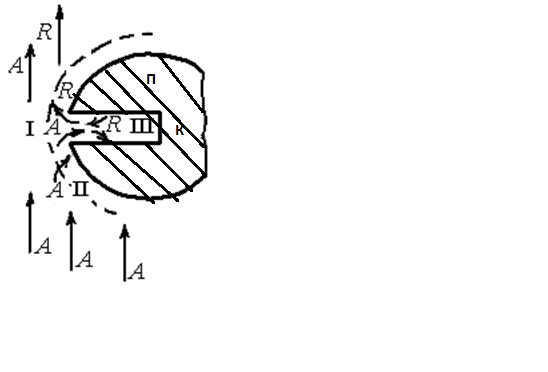 К – катализатор, П - пора катализатора
К – катализатор, П - пора катализатора
Пс - пограничный слой,
А - поток исходного реагента, R - продукт реакции
I, II, III, IV - этапы процесса
Сначала реагенты диффундируют из газового объема А через пограничный слой Пс к наружной поверхности частицы катализатора К (этап I); Затем проникают в его поры П (этап II), при движении в которых на их поверхности протекает реакция (этап III). Продукты R удаляются обратным путем (этап IV). Основные стадии процесса взаимодействия газообразного реагента с зерном пористого катализатора
1 стадия ( стадией внешней диффузии)– диффузия газообразного реагента А из основного потока к внешней поверхности зерна катализатора К через пограничный слой Пс, в котором концентрация А ниже, а концентрация продукта R выше, чем в основном потоке. 2 стадия( стадией внутренней диффузии) Основная часть молекул газообразного реагента А диффундирует внутри пор катализатора К (стадия внутренней диффузии).Скорость диффузии молекул через пористую среду во много раз меньше скорости их поступательного движения. Во время прохождения через катализатор молекулы сталкиваются со стенками пор и с другими молекулами, что приводит к беспорядочному их движению. 3 стадия. Молекулы реагента адсорбируются на поверхности катализатора. Адсорбция-это явление концентрирования вещества (адсорбента) из объема фаз на поверхности раздела между ними, например, из газа или раствора на поверхности или в объеме микропористого тела(адсорбента) или на поверхности жидкости. Различают физическую адсорбацию и темосорбацию в зависимости от того, какова природа сил, вызывающих это концентрирование молекул адсорбата на поверхности раздела фаз. При протекании каталитических процессов основная роль принадлежит хемосорбации или активированной адсорбации, результатом которого является образование активированного комплекса адсорбации -неустойчивого промежуточного соединения между реагентом и катализатором.
4 стадия. поверхностная химическая реакция, которая заключается либо в перегруппировке активированного комплекса адсорбации, либо во взаимодействии одного адсорбированного реагента с молекулами другого реагента. Механизм этой реакции может быть различным; от него зависит вид кинетического уравнения. В результате поверхностной реакции образуется адсорбированный продукт.
5 стадия. десорбция продукта с поверхности катализатора.На этом этапе также проявляются специфические свойства катализатора: энергия связи адсорбированного продукта и адсорбента должна быть такой, чтобы десорбция в объем не вызывала затруднений. Стадии 3,4,5 являются центральными в ходе каталитического процесса. Суммарно их можно рассматривать как поверхностную химическую реакцию. Эти стадии могут протекать одновременно с предыдущими- диффузионными стадиями - причем как на внешней поверхности зерна катализатора, так и, в основном на внутренней поверхности пор. 6 стадия. Десорбированные газообразные продукты диффундируют из пор к внешней поверхности катализатора (обратная внутренняя диффузия). 7 стадия. Газообразные продукты диффундируют от поверхности катализатора в газовый поток через пограничную пленку, окружающую зерно катализатора. Кинетическое уравнение контактного процесса, проходящего в изотермических условиях очень сложное. Считается, что одна из стадий оказывает основное сопротивление и лимитирует скорость процесса.
Факторы, влияющие на гетерогенные каталитические процессы:
1. Влияние массопередачи в порах Каталитическая реакция протекает в основном на поверхности пор катализатора, так как внутренняя поверхность катализатора на несколько порядков больше внешней. Если диффузия в порах катализатора протекает быстрее по сравнению с химической реакцией, то вся доступная поверхность катализатора принимает участие в реакции, так как реагенты достигаю поверхности пор, прежде чем прореагируют. В таком случае наблюдается установившийся диффузиционный поток, перемещающий реагирующие молекулы внутрь частиц катализатора и выводящий из них образующиеся молекулы.
Для «медленных» химических реакций полезной оказывается практически вся внутренняя поверхность катализатора. В случае «быстрых» реакций на очень активном катализаторе реагирующие вещества превращаются в конечные продукты еще до того, как проникают в глубь пор.В зависимости от соотношения интенсивности двух параллельно протекающих процессов: диффузии в поры и химической реакции, внутренняя поверхность катализатора используется с большей или меньшей эффективностью.
2. Эффективность использования внутренней поверхности катализатора
Количественно эффективность использования поверхности катализатора оценивают коэффициентом эффективности – Е - отношение средней скорости расходования реагента в порах катализатора к максимальной скорости расходования, которая имела бы место в отсутствие тормозящего влияния внутренней диффузии.
3. Стадия адсорбции При физической адсорбции равновесия между адсорбированными частицами и частицами, находящимися в газовой фазе устанавливается быстро. Физическая адсорбция вызывается теми же силами межмолекулярного взаимодействия, что и конденсация паров. Эти силы неспецифичны. Теплота физической адсорбции невелика, она близка к теплоте конденсации и составляет обычно 10-40 кДж/моль. Физическая адсорбция играет существенную роль тогда, когда температура газа понижается ниже критической, то есть когда газ находится в виде пара. Хемосорбция отличается от физической адсорбции значительно большей специфичностью, то есть зависимостью от химической природы адсорбента и адсорбента. Теплоты хемосорбции близка к теплотам химический реакций. Хемосорбированные вещества удалить с поверхности адсорбента значительно труднее, чес при физической адсорбции, причем десорбция может сопровождаться химическими реакциями. Процесс хемосорбции может состоять из двух стадий: сначала происходит быстрая физическая адсорбция газа, а затем он вступает в медленную химическую реакцию с поверхностью твердого тела. При низких температурах скорость хемосорбции мала. Практически наблюдается только физическая адсорбция. Скорость гетерогенно-каталитических реакций пропорциональна поверхностным концентрациям адсорбированных молекул.
4.Влияние характера адсорбции на кинетику гетерогенного катализа.
Для расчета каталитического реактора необходимо иметь конкретный вид кинетического уравнения, то есть зависимость скорости процесса от концентрации реагентов, температуры и т. д. При аналогии с гомогенными системами скорость каталитической реакции зависит от поверхностных концентраций адсорбированных частиц. На практике известны не поверхностные, а объёмные концентрации компонентов в газовой фазе или их парциальные давления. Поэтому обычно кинетические уравнения гетерогенно-каталитических реакций представляют в виде зависимости скорости от концентраций реагентов в газовой фазе (или парциальных давлений.
Дата публикования: 2015-10-09; Прочитано: 2357 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
