 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Приготовление фиксированных окрашенных препаратов
|
|
Окраска простая и сложная (по Граму)
Цель занятия. Освоение методов приготовления и окрашивания бактериальных препаратов.
Задание: Освоить технику приготовления и окрашивания мазка из зубного налета. Посмотреть с иммерсионным объективом окрашенные мазки; определить и зарисовать обнаруженные формы и взаиморасположение микроорганизмов. Ответить на поставленные вопросы.
1.Приготовление бактериальных препаратов
Препарат — мазок для окрашивания, приготовляется в несколько этапов: приготовление препарата; высушивание; фиксация; окраска.
Для приготовления препарата используют предметное стекло - тонкую стеклянную пластинку размером 76x26 мм с хорошо отшлифованными краями.
При микроскопировании применяют покровные стекла толщиной 0,15-0,17 мм и размером 18x18, 20x20, 18x24 мм. Их подготавливают заранее обезжиренными.
Чистые стекла берут пинцетом, так как пальцы оставляют на них жирные пятна. Если стекла находятся в жидкой среде, их перед употреблением обсушивают фильтровальной бумагой и слегка обжигают над пламенем горелки. При длительном употреблении стекла мутнеют и становятся непригодными для работы.
Препарат-мазок готовится при помощи бактериологических петель или пастеровских пипеток.
Бактериологическую петлю готовят из платиновой или нихромовой проволоки длиной 5-7 см, толщиной 0,5 мм и припаивают к ней стеклянную ручку или вставляют ее в металлическую — петледержатель. Такая проволока легко стерилизуется на пламени и быстро остывает.
Пастеровские пипетки выполняют из стеклянных трубок диаметром 3-6 мм.
Для приготовления препарата-мазка исследуемую культуру микроба осторожно распределяют равномерным тонким слоем на предметном стекле.
Мазок из культур, выросших на плотных средах, готовят в определенной последовательности.
На чистое предметное стекло стерильной пипеткой или бактериологической петлей наносят каплю воды или физиологического раствора. Пробирку с культурой, из которой необходимо приготовить мазок, в наклонном положении помещают на указательном и среднем пальцах левой руки и сверху прижимают большим пальцем так, чтобы хорошо была видна вся поверхность питательной среды с выросшими на ней микроорганизмами (рис. а-з).
Прежде чем взять материал из культуры, необходимо прокалить бактериологическую петлю в пламени горелки до покраснения. При этом петля должна находиться в вертикальном положении (а), чтобы пламя охватывало не только всю петлю, но и часть иглодержателя.
При работе петлю или пипетку держат в правой руке, как карандаш при письме. Зажав пробку между мизинцем и ладонью правой руки (в ней же находится подготовленная петля), вынимают ее из пробирки (б) и держат концом вниз, не допуская соприкосновения с рукой той части пробки, которая находилась в пробирке. Открытый конец пробирки обжигают на пламени (в) и отводят несколько к себе, затем вводят в пробирку петлю (еще раз проведя ее через пламя), охлаждают прикосновением к стенке пробирки (а) и набирают небольшое количество материала, слегка прикасаясь к культуре и не царапая среды петлей.
После взятия материала (д) пробирку тотчас закрывают той же ватной пробкой (е), а перед этим края пробирки и конец ватной пробки обжигают на пламени горелки. Взятый материал эмульгируют (ж) в имеющейся на предметном стекле капле и равномерно тонким слоем петлей распределяют по поверхности (1,5x2 см).
 Схема приготовления мазка
Схема приготовления мазка 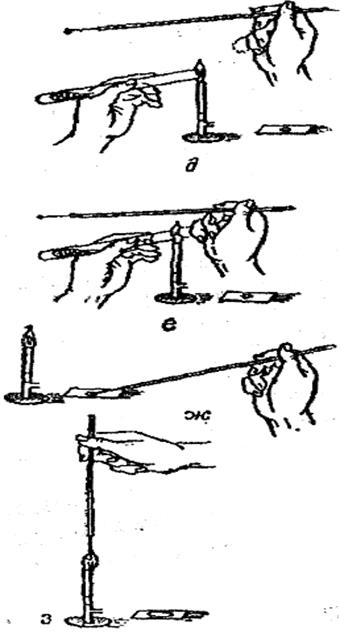
Если культура выращена на жидкой питательной среде, то стерильную петлю опускают в жидкость, захватывают каплю и растирают ее на предметном стекле. На обратной стороне стекла обводят восковым карандашом место, где приготовлен мазок. Это облегчает в дальнейшем нахождение его. После этого петлю прокаливают (д), с тем, чтобы убить оставшиеся на ней микроорганизмы, и кладут на место.
Для приготовления мазка можно пользоваться и стерильной пипеткой. Пастеровскую пипетку предварительно проводят над пламенем горелки, затем пинцетом над прокаленным пламенем горелки обламывают тонкий запаянный конец пипетки и набирают материал. Использованную пипетку опускают в сосуд с дезинфицирующим раствором (5 %-м раствором фенола).
2.Препарат-мазок из зубного налета готовят следующим образом.
На предметное стекло наносят бактериологической петлей каплю физиологического раствора или воды, затем осторожно снимают зубной налет спичкой (без серной головки), растирают в капле и тонким слоем распределяют по поверхности стекла. Мазок подсушивают на воздухе, фиксируют и окрашивают.
Высушивание приготовленного препарата производится на воздухе или в термостате. Подогревать препарат не рекомендуется, так как при быстрой потере влаги происходит грубое свертывание белков, и клетка теряет естественную форму. При высушивании препарат предохраняют от мух, накрывая стеклянным колпаком.
Фиксация высушенного препарата преследует цели: обеспечить лучшее прилипание микробных клеток к стеклу, убить микроорганизмы (мертвые клетки окрашиваются лучше живых).
Фиксация препарата производится над пламенем спиртовки или газовой горелки. Предметное стекло берут за уголки большим и указательным пальцами и медленно проводят, держа стороной с нанесенным препаратом вверх, через пламя не менее трех раз. В общей сложности мазок должен подвергаться действию пламени не более 2 с. Длительная фиксация может изменить структуру микробных клеток и их форму; недостаточно зафиксированный мазок смывается со стекла при последующей обработке. Для фиксации можно использовать различные химические вещества. В абсолютном спирте мазки выдерживают 15-30 мин, в смеси равных объемов спирта и эфира —2-5 мин., в метиловом и амиловом спирте — 5 мин. Фиксируют препарат, погружая мазок в кювету с одним из указанных веществ или наливая последние на мазок.
3.Метод простой окраски. При простом методе окраски используется один какой-нибудь красящий раствор, чаще всего фуксин Пфейффера или метиленовый синий.
Техника окраски. На фиксированный препарат помещают пипеткой несколько капель красящего раствора так, чтобы покрыть всю поверхность мазка.
Фуксином Пфейффера красят 1-2 мин., метиленовым синим раствором — 3-5 мин. Затем краску смывают водой, а мазок просушивают между листочками фильтровальной бумаги или на воздухе.
Сложные методы окраски применяют в целях диагностики, выявления отличительных структур микробов в случаях, когда последние не окрашиваются простым способом. К сложным методам относятся, например, окраска по Граму, окраска спор, капсул и др.
4.Окраска по Граму. Универсальный дифференциально-диагностический метод окраски.
По отношению к окраске по Граму все виды микробов принято делить на две группы: грамположительные (грампозитивные) и грамотрицательные (грамнегативные).
Метод окраски по Граму основан на использовании способности магниевых солей рибонуклеиновой кислоты, содержащихся в цитоплазме целого ряда микробов (грамположительных), вступать в реакцию с генциан- или кристаллвиолетом и йодом, образовывая стойкое соединение, не разрушающееся при последующем воздействии спирта,
Грамотрицательные микробы, имеющие иной состав цитоплазмы, прочного соединения с генцианвиолетом не образуют и при обработке спиртом обесцвечиваются, а при дополнительной окраске водным раствором фуксина окрашиваются в розово-красный цвет.
Техника окраски по Граму
На обычно приготовленный и фиксированный мазок кладут полоску фильтровальной бумаги (несколько уже и короче предметного стекла) и на нее капают карболовый раствор генцианвиолета или кристаллвиолета на 2 мин. Затем бумагу удаляют, краску сливают, и на препарат наливают люголевский раствор на 2 мин. (мазок чернеет). Сливают люголевский раствор и в течение 30 с обрабатывают 96-градусным спиртом. Промывают водой. Дополнительно 2 мин. окрашивают фуксином Пфейффера. Промывают водой, высушивают и микроскопируют (исследуют под микроскопом).
При этом грамположительные микробы окрашиваются в темно-фиолетовый, почти черный, цвет, а грамотрицательные — в розово-красный.
Шаровидные формы микробов (кокки) в большинстве своем красятся по Граму положительно, извитые формы — отрицательно. Среди палочковидных форм микробов встречаются и грамположительные, и грамотрицательные (палочки, образующие споры, окрашиваются обычно положительно).
5.Рост бактерий. Рост популяции
Когда бактериальные клетки достигают определенных размеров, они переходят к бесполому размножению, которое называется простым делением; при этом клетка делится на две идентичные дочерние клетки. Если одиночную бактерию поместить в питательную среду в оптимальных условиях роста, то она и ее потомки будут делиться каждые 30 мин.
В идеальных условиях рост бактерий является экспоненциальным. При экспоненциальном росте время, которое требуется для удвоения числа бактерий, постоянно. Оно называется временем удвоения, или временем генерации. Идеальную модель роста популяции бактерий можно сравнить с ростом реальной популяции в закрытом сосуде, где нет внешних воздействий, например не добавляются питательные вещества. Графическое отображение численности жизнеспособных бактерий имеет четыре фазы. Первая — это лаг-фаза, в ходе которой бактерии адаптируются к новой среде обитания, и максимальная скорость роста не достигается. В этот период в клетках бактерий могут, например, синтезироваться новые ферменты, необходимые для усвоения тех питательных веществ, которые присутствуют в новой среде.
Следующая фаза роста популяции бактерий - логарифмическая, когда бактерии растут с максимальной скоростью, число бактерий увеличивается почти экспоненциально, т. е. кривая роста представляет собой почти прямую линию. В ходе этой фазы время удвоения остается постоянным и имеет минимальное значение.
Со временем рост колонии начинает замедляться, время удвоения начинает увеличиваться, и культура входит в стационарную фазу, когда скорость роста популяции равна нулю и когда резко возрастает конкуренция за пищевые ресурсы. Образование новых клеток замедляется и затем совсем прекращается. Любое увеличение числа клеток компенсируется одновременной гибелью других клеток, поэтому суммарная численность живых клеток остается постоянной. Переход к этой фазе определяется действием ряда факторов: истощением необходимых питательных веществ, накоплением токсичных продуктов распада, таких как спирт, а в случае аэробных бактерий еще и ограничением доступа кислорода. Рост бактерий замедляется также при изменении рН.
Во время последней фазы - фазы замедления роста - возрастает скорость гибели клеток, и она становится выше, чем скорость размножения. Со временем клетки вообще прекращают воспроизводиться. Те же принципы применимы к росту любых популяций, даже популяций человека. Теоретически любая популяция может достичь экспоненциального роста, если время удвоения остается постоянным. Однако в действительности, рано или поздно в дело вступают лимитирующие факторы и изменяют темпы роста популяции.
Рост бактерий не всегда сопровождается делением. Многие факторы - детергенты, антибиотики, соли жёлчных кислот, УФ-облучение — задерживают деление клеток. В результате образуются длинные нитевидные формы, значительно превышающие по размерам исходные клетки.
6.Оценка роста бактерий.
Дата публикования: 2015-10-09; Прочитано: 6229 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
