 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Задание к лабораторной работе по восстановлению диоксида углерода
|
|
1. Определить влияние температуры на степень превращения и скорость процесса восстановления СО2. Рекомендуемый диапазон температур – 973–1273 К.
2. Определить влияние объемной скорости газового потока на степень превращения СО2 и скорость процесса восстановления.
3. По результатам экспериментального исследования следует построить графические зависимости степени превращения и скорости превращения от соответствующих параметров процесса.
4. На основании анализа экспериментальных данных и известных теоретических положений сделать вывод об оптимальных условиях проведения процесса и путях его интенсификации.
Разложение карбонатов и синтез силикатов
Цель работы – исследование гетерогенного эндотермического процесса в системе твердое – газ на примере высокотемпературного разложения карбонатов и изучение влияния технологических параметров (температуры, дисперсности) на показатели процесса (степень и скорость превращения).
Общие положения
Обжиг карбонатного сырья – крупнотоннажный процесс, который используется в различных отраслях народного хозяйства: в производстве строительных материалов, металлургии, химии, сахарной промышленности и др. Обычно обжиг известняка и мела проводят в шахтных печах, иногда в барабанных вращающихся печах или в печах с кипящим слоем.
Разложение карбоната кальция протекает по реакции
СаСО3 Û СаО + СО2; DН°298 = 178,43 кДж/моль
и сопровождается значительным поглощением тепла. Тепловой эффект реакции в интервале температур 1173–1473 К равен в среднем 158,7 кДж/моль.
Поскольку СаСО3 и СаО твердые вещества, то выражение для константы равновесия можно записать следующим образом:
КР =  . (28)
. (28)
Данные о зависимости равновесного парциального давления от температуры приведены в табл. 4.
Табл. 4. Равновесное парциальное давление СО2 над СаСО3
| Температура, К | ||||||
| Давление, кПа | 24,398 | 31,330 | 33,997 | 41,463 | 50,795 | 73,593 |
| Температура, К | ||||||
| Давление, кПа | 80,392 | 91,191 | 95,457 | 101,323 | 199,713 | 361,297 |
Равновесное давление СО2, равное атмосферному, достигается при температуре 1171 К, следовательно, это наименьшая температура, при которой обеспечивается необходимая скорость разложения карбоната кальция. Равновесное давление зависит также от размеров кристаллов карбоната, поэтому реальная величина равновесного парциального давления для известняка различных месторождений, мрамора и мела может отличаться от приведенных в табл. 4.
Скорость разложения СаСО3 выражается уравнением
v = v1 – v2, (29)
где v1 и v2 – скорость прямой и обратной реакций.
Учитывая, что скорость обратной реакции незначительна, уравнение скорости можно представить следующим образом:
v = dG / dt = K ×  , (30)
, (30)
где К – константа скорости реакции;  – парциальное давление СО2.
– парциальное давление СО2.
Из уравнения следует, что скорость разложения известняка пропорциональна парциальному давлению диоксида углерода и с повышением температуры обжига скорость процесса увеличивается. Оптимальная температура обжига – 1172–1273 К. Кроме температуры обжига, на скорость разложения оказывает влияние размер частиц, наличие примесей и другие факторы. Примеси легкоплавких соединений, как правило, увеличивают скорость разложения. Например, высокотемпературный синтез силикатов осуществляется по суммарному уравнению
nMеCO3 + mSiO2 Û nMеO × mSiO2 + nCO2; DН > 0.
Значение константы равновесия будет определяться парциальным давлением СО2 согласно формуле 28. В случае присутствия легкоплавких веществ или эвтектик константа равновесия будет зависеть от концентрации компонентов в жидкой фазе
КР = P n 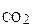 [nMeO × mSiO2] / [MeCO3]n[SiO2]m. (31)
[nMeO × mSiO2] / [MeCO3]n[SiO2]m. (31)
Давление диоксида углерода над реакционной смесью будет значительно зависеть от растворимости исходных и конечных веществ в расплаве.
В начале процесса обжига шихты разлагаются карбонаты с образованием оксидов и СО2. Затем оксиды взаимодействуют с диоксидом кремния с образованием соответствующих силикатов
2МеО + SiO2 Û 2МеО × SiO2.
Дата публикования: 2015-10-09; Прочитано: 474 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
