 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Дегидрирования ЭБ
|
|
Целью термодинамических исследований является качественная и количественная оценка влияния температуры, давления и исходного состава реагентов на равновесие химических реакций, прогнозирование предельной эффективности процессов.
Качественную оценку можно выполнить на базе стехиометрического уравнения и знака теплового эффекта (правило Ле-Шателье). Такая оценка позволяет качественно определить направление смещения равновесия при изменении температуры, давления и концентраций. Количественную оценку выполняют расчетами, в основе которых лежат законы термодинамики.
Разработка каждого химико-технологического процесса определяется, в первую очередь, принципиальной возможностью его осуществления в тех или иных случаях, которые обусловлены знаком и величиной характеристической функции. Любую из этих функций в соответствующих условиях можно использовать в качестве критерия самопроизвольности и направленности процесса перехода систем из одного состояния в другое.
В практике химико-технологических исследований в качестве такого количественного критерия используется стандартное значение изобарно-изотермического потенциала. Это связано с тем, что химические процессы, в основном протекают при постоянных температуре и давлении, когда изоля-
ции системы не требуется. Именно температура и давление в момент равновесия становятся равными во всех фазах системы.
Для термодинамического анализа системы, составления уравнений теплового баланса и инженерных расчетов необходимо иметь данные по тепловому эффекту реакции. Методы расчета энтальпии и энергии Гиббса, известные студентам из курса физической химии, приведены в работах [8-11]. В данном разделе эти характеристики определяются по известным значениям термодинамических функций отдельных компонентов для заданных температур (приложения, табл. 1.2).
Количественная оценка равновесия химических процессов сводится к решению прямой термодинамической задачи. В качестве математического описания используется закон действия масс – уравнение константы равновесия реакции. В результате его решения определяется экстенсивная степень полноты реакции, равновесный состав продуктов и равновесная степень превращения сырья. Последовательность количественного термодинамического анализа единичной реакции приведена в табл. 1.1
Для расчета равновесия сложной химической схемы с учетом побочных превращений необходимо решить систему уравнений констант равновесия целевой и побочных реакций:
Кpi= 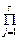 (Pji)ji.
(Pji)ji.
В этом случае равновесный состав для всех компонентов системы выражается уравнением:
N*j = Noj + 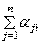 X*i,
X*i,
где n – число реакций.
По заданию преподавателя студентами выполняются расчеты изобарно-изотермических потенциалов побочных реакций (деалкилирование, деструктивный гидрогенолиз этилбензола и др.), проводится сравнение их с изобарным потенциалом целевой реакции по графику зависимости от
Таблица 1.1.
Дата публикования: 2015-10-09; Прочитано: 693 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
