 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Обработка и анализ результатов эксперимента
|
|
2.6.1. Материальный баланс системы дегидрирования
В основе составления материального баланса лежит качественный и количественный анализ состава входящих и выходящих потоков. Балансовый расчет проводится на единицу массы, а для непрерывных процессов и на единицу времени. Последний метод дает наибольшую информацию, так как позволяет судить о скорости потоков.




 1-ЭБ 3
1-ЭБ 3
 |  |



 4
4

 2-Н2О
2-Н2О
Рис. 4. Структура материальных потоков:
1-этилбензол; 2-водяной пар; 3-легкие газы (ЛГ); 4-углеводородный конденсат (УК); 5-водяной конденсат (ВК); Х-хладоагент
Составить материальный баланс по экспериментальным данным. Результаты оформить таблицей (табл. 7, приложение).
Количество легких газов на выходе из системы можно принять равным 3-5 % масс. или пренебречь.
2.6.2. Расчет основных характеристик процесса
Результаты расчета материального баланса являются исходными данными для определения наиболее важных технологических показателей процесса дегидрирования:
1. Конверсия ЭБ: χ = 
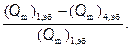

2. Селективность по стиролу: φ = 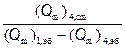 .
.
3. Выход стирола: η =  .
.
4. Интенсивность по стиролу: J =  .
.
5. Расходный коэффициент по ЭБ на СТ: А = 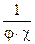 .
.
6. Расходный коэффициент по водяному пару на стирол:
В =  .
.
Все определяемые величины являются интегральными, так как получены в реакторе интегрального типа. После расчета проводится обсуждение полученных результатов для оценки приближения конверсии к равновесному значению при заданных температуре и степени разбавления. Для этого используется отношение χ/χ*. Далее анализируются причины неравенства выход <1, предлагаются возможные пути снижения расходных коэффициентов и способы их осуществления.
2.6.3. Описание кинетики реакции дегидрирования
этилбензола.
Целью данного раздела является установление кинетической модели процесса, адекватно описывающей экспериментальные данные. Производится сравнительная оценка средней скорости реакции, полученной в эксперименте и рассчитанной по одному из кинетических уравнений реакции дегидрирования, применимых для железохромкалиевых катализаторов.
1. Определение экспериментальной средней скорости реакции:
r эксп = (m 0- m)/ M эб, моль/(м3 с),
где m 0 = ω · ρ; m = m 0 (1 - χ эб).
Поделив найденную скорость реакции на насыпную массу катализатора, можно выразить ее в моль/кг с.
2. Расчет теоретической средней скорости реакции.
Обобщение полученных результатов и литературных сведений о механизме аналитических превращений алкилбензолов позволяет предположить следующую стадийную схему
процесса:
1. C6H5C2H5+Z 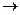 C6H5C2H5Z
C6H5C2H5Z
2. C6H5C2H5Z+Z 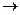 C6H5C2H4Z+HZ
C6H5C2H4Z+HZ
3. C6H5C2H4Z+Z 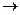 C6H5C2H3Z+Z
C6H5C2H3Z+Z
4. C6H5C2H3Z 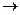 C6H5C2H3+Z
C6H5C2H3+Z
5. 2HZ 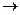 H2+2Z
H2+2Z
6. C6H5C2H5Z+Z 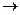 CH3Z+C6H5CH2Z
CH3Z+C6H5CH2Z
7. C6H5CH2Z+HZ 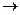 C6H5CH3+2Z
C6H5CH3+2Z
8. CH3Z+HZ 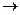 CH4+2Z
CH4+2Z
где Z – активный центр поверхности катализатора.
На основании полученных экспериментальных данных, с учетом обоснованного ранее механизма реакции с лимитирующей стадией взаимодействия адсорбированной молекулы со свободным активным центром поверхности, кинетическая модель может быть представлена уравнениями следующего вида:


где 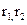 - скорость накопления стирола и побочных продуктов,
- скорость накопления стирола и побочных продуктов,
соответственно, моль/кг с;
 - парциальные давления ЭБ и стирола, гПа;
- парциальные давления ЭБ и стирола, гПа;
 - константы.
- константы.
Текущие парциальные давления компонентов могут быть найдены по зависимостям:
P эб = P 0эб(1 - χэб),
P H2 = P cm = P0эб · χэб · φст,
где P 0эб - исходное парциальное давление сырья.
После расчета экспериментальной и теоретической скоростей реакции для оценки адекватности модели принятую кинетическую модель используют дальше для расчета про-
мышленного реактора.
Применимость указанных уравнений проверялась расчетом на ЭВМ. В результате были получены следующие выражения для констант:
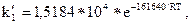 моль/кг с Па,
моль/кг с Па,
 Па-1,
Па-1,

 моль/кг с Па,
моль/кг с Па,
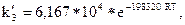 моль/кг с Па.
моль/кг с Па.
Дата публикования: 2015-10-09; Прочитано: 542 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
