 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Опыт №2. Определение теплового эффекта реакции взаимодействия металла с кислотой
|
|
Реакция взаимодействия металла с кислотой является экзотермической, так как происходит с выделением теплоты.
Методика опыта. Во внутренний стакан калориметра помещаем небольшое количество гранулированного магния Mg и наливаем 2,5 см3 раствора серной кислоты H2SO4 с молярной концентрацией эквивалентов 1 моль/дм3.
Запишите, чему была равна температура кислоты на момент начала реакции и какая максимальная температура была достигнута в ходе реакции.
В ходе опыта происходит следующая реакция:
Mg + H2SO4 = MgSO4 + H2↑
Тепловой эффект реакции взаимодействия металла с кислотой рассчитываем по формуле:
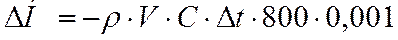 ,
,
где ρ – плотность раствора кислоты, г/см3;
V – объём раствора кислоты, см3;
С – удельная теплоёмкость раствора, Дж/г·К;
Δt – разность температур, °С;
800 – коэффициент пересчёта на один моль взятой кислоты;
0,001 – коэффициент пересчёта Дж в кДж.
Запишите расчёт теплового эффекта реакции взаимодействия металла с кислотой по вышеуказанной формуле.
Запишите расчёт теоретического значения теплового эффекта реакции взаимодействия металла с кислотой ΔНтеор по первому следствию из закона Гёсса: сначала в общем виде, а затем с подставленными табличными значениями энтальпий образования веществ (см. приложение Б).
Относительную ошибку опыта рассчитываем по формуле:
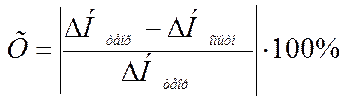 ,
,
где ΔНтеор – теоретическое значение величины теплового эффекта, кДж;
ΔНопытн – значение величины теплового эффекта, полученное в ходе опыта, кДж.
Запишите расчёт величины относительной ошибки опыта по вышеуказанной формуле.
Сделайте вывод о тепловом эффекте реакции взаимодействия металла с кислотой и укажите, с какой ошибкой он был найден в данном случае.
Вопросы для защиты лабораторной работы:
1. Что такое энтальпия (тепловой эффект) химической реакции?
2. Как называются химические реакции, протекающие с выделением теплоты?
3. Как называются химические реакции, протекающие с поглощением теплоты?
4. Формулировка закона Гёсса.
5. Первое следствие из закона Гёсса.
6. Как рассчитать тепловой эффект реакции по значениям энтальпий образования вступающих в реакцию и образующихся веществ?
7. Второе следствие из закона Гёсса.
Рекомендуемая литература:
1. Н.Л. Глинка. «Общая химия». Главы «Превращения энергии при химических реакциях», «Термохимия», «Термохимические расчеты», «Термодинамические величины. Внутренняя энергия и энтальпия», Стандартные термодинамические величины. Химико-термодинамические расчеты».
2. Е.М. Рыбалкин, О.Ю. Ковалик. «Химия. Учебное наглядное пособие». Глава «Химическая термодинамика».
3. П.Г. Пермяков, М.Х. Ахметов, С.В. Зенцова. «Основные закономерности протекания химических процессов в газообразных и конденсированных системах. Учебное пособие». Глава «Химическая термодинамика».
4. Р.М. Белкина, Р.И. Славкина, В.Ф. Горюшкин. «Энергетика химических процессов. Задания для практических занятий».
Дата публикования: 2015-09-18; Прочитано: 426 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
