 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Вивчення нового матеріалу. Термодинаміка - це наука про теплові явища
|
|
Термодинаміка - це наука про теплові явища. В протилежність молекулярно-кінетичній теорії, яка робить висновки на основі уявлень про молекулярну будову речовини, термодинаміка виходить з найбільш загальних закономірностей теплових процесів і властивостей макроскопічних систем. Висновки термодинаміки спираються на сукупність досвідчених фактів і не залежать від наших знань про внутрішній устрій речовини, хоча у цілому ряді випадків термодинаміка використовує молекулярно-кінетичні моделі для ілюстрації своїх виводів.
Термодинаміка розглядає ізольовані системи тіл, що знаходяться в стані термодинамічної рівноваги. Це означає, що в таких системах припинилися усі спостережувані макроскопічні процеси. Важливою властивістю термодинамічно рівноважної системи являється вирівнювання температури усіх її частин.
Якщо термодинамічна система була схильна до зовнішньої дії, то зрештою вона перейде в інший рівноважний стан. Такий перехід називається термодинамічним процесом. Якщо процес протікає досить повільно (у межі нескінченно повільно), то система в кожен момент часу виявляється близькою до рівноважного стану. Процеси, що складаються з послідовності рівноважних станів, називаються квазістатичними.
Одним з найважливіших понять термодинаміки є внутрішня енергія тіла. Усі макроскопічні тіла мають енергію, ув'язнену усередині самих тіл. З точки зору молекулярно-кінетичної теорії внутрішня енергія речовини складається з кінетичної енергії усіх атомів і молекул і потенційної енергії їх взаємодії один з одним. Зокрема, внутрішня енергія ідеального газу дорівнює сумі кінетичних енергій усіх часток газу, що знаходяться в безперервному і безладному тепловому русі. Звідси витікає закон Джоуля, що підтверджується численними експериментами.
Внутрішня енергія ідеального газу залежить тільки від його температури і не залежить від об'єму
Молекулярно-кінетична теорія призводить до наступного виразу для внутрішньої енергії одного моля ідеального одноатомного газу (гелій, неон та ін.), молекули якого здійснюють тільки поступальний рух:
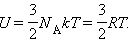
Оскільки потенційна енергія взаємодії молекул залежить від відстані між ними, в загальному випадку внутрішня енергія U тіла залежить разом з температурою T також і від об'єму V:
U = U (T, V).
Таким чином, внутрішня енергія U тіла однозначно визначається макроскопічними параметрами, що характеризують стан тіла. Вона не залежить від того, яким чином було реалізовано цей стан. Прийнято говорити, що внутрішня енергія є функцією стану.
Внутрішня енергія тіла може змінюватися, якщо діючі на нього зовнішні сили здійснюють роботу (позитивну або негативну). Наприклад, якщо газ піддається стискуванню в циліндрі під поршнем, то зовнішні сили здійснюють над газом деяку позитивну роботу A'. В той же час сили тиску, діючі з боку газу на поршень, здійснюють роботу A = - A'. Якщо об'єм газу змінився на малу величину ΔV, то газ здійснює роботу pSΔx = pΔV, де p - тиск газу, S - площа поршня, Δx - його переміщення (мал. 3.8.1). При розширенні робота, що здійснюється газом, позитивна, при стискуванні - негативна. У загальному випадку при переході з деякого початкового стану (1) в кінцевий стан (2) робота газу виражається формулою:
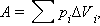
чи в межі при ΔVi → 0:

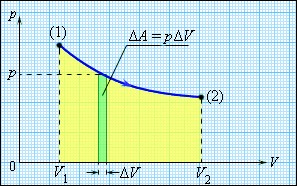
Малюнок 1.
Робота газу при розширенні
Робота чисельно дорівнює площі під графіком процесу на діаграмі (p, V). Величина роботи залежить від того, яким чином здійснювався перехід з початкового стану в кінцевий. На мал. 2 зображено три різні процеси, що переводять газ із стану (1) в стан (2). У усіх трьох випадках газ здійснює різну роботу.
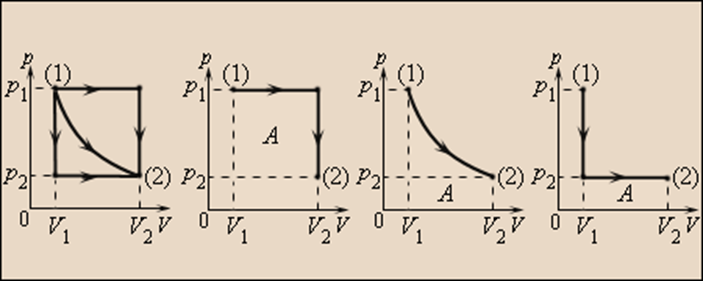
Малюнок 2.
Три різні шляхи переходу із стану (1) в стан (2). У усіх трьох випадках газ здійснює різну роботу, рівну площі під графіком процесу
Процеси, зображені на мал.2, можна провести і у зворотному напрямі; тоді робота A просто змінить знак на протилежний. Процеси такого роду, які можна проводити в обох напрямах, називаються оборотними.
На відміну від газу, рідини і тверді тіла мало змінюють свій об'єм, так що у багатьох випадках роботою, що здійснюється при розширенні або стискуванні, можна нехтувати. Проте, внутрішня енергія рідких і твердих тіл також може змінюватися в результаті здійснення роботи. При механічній обробці деталей (наприклад, при свердлінні) вони нагріваються. Це означає, що змінюється їх внутрішня енергія. Іншим прикладом може служити дослід Джоуля (1843 р.) по визначенню механічного еквіваленту теплоти (мал.3). При обертанні вертушки, зануреної в рідину, зовнішні сили здійснюють позитивну роботу (A' > 0); при цьому рідина із-за наявності сил внутрішнього тертя нагрівається, тобто збільшується її внутрішня енергія. У цих двох прикладах процеси не можуть бути проведені в протилежному напрямі. Такі процеси називаються безповоротними.
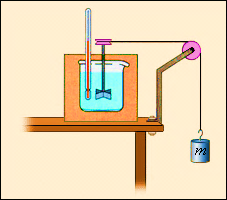
Малюнок 3.
Спрощена схема досвіду Джоуля для визначення механічного еквіваленту теплоти
Внутрішня енергія тіла може змінюватися не лише в результаті здійснюваної роботи, але і внаслідок теплообміну. При тепловому контакті тіл внутрішня енергія одного з них може збільшуватися, а іншого - зменшуватися. В цьому випадку говорять про тепловий потік від одного тіла до іншого. Кількістю теплоти Q, отриманим тілом, називають зміну внутрішньої енергії тіла в результаті теплообміну.
Передача енергії від одного тіла іншому у формі тепла може відбуватися тільки за наявності різниці температур між ними.
Тепловий потік завжди спрямований від гарячого тіла до холодного.
Кількість теплоти Q є енергетичною величиною. У СІ кількість теплоти вимірюється в одиницях механічної роботи - джоулях (Дж).
На мал. 4 умовно зображені енергетичні потоки між виділеною термодинамічною системою і навколишніми тілами. Величина Q > 0, якщо тепловий потік спрямований у бік термодинамічної системи. Величина A > 0, якщо система здійснює позитивну роботу над навколишніми тілами.
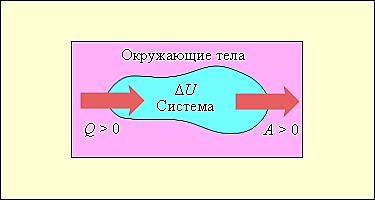
Малюнок 4.
Якщо система обмінюється теплом з навколишніми тілами і здійснює роботу (позитивну або негативну), то змінюється стан системи, тобто змінюються її макроскопічні параметри (температура, тиск, об'єм). Оскільки внутрішня енергія U однозначно визначається макроскопічними параметрами, що характеризують стан системи, то звідси витікає, що процеси теплообміну і здійснення роботи супроводжуються зміноюΔU внутрішньої енергії системи.
Перший закон термодинаміки є узагальненням закону збереження і перетворення енергії для термодинамічної системи. Він формулюється таким чином:
Зміна ΔU внутрішньої енергії неізольованої термодинамічної системи дорівнює різниці між кількістю теплоти Q, переданій системі, і роботою A, виконаною системою над зовнішніми тілами.
ΔU = Q - A.
Співвідношення, що виражає перший закон термодинаміки, часто записують в іншій формі:
Q = ΔU + A.
Кількість теплоти, отримана системою, йде на зміну її внутрішньої енергії і здійснення роботи над зовнішніми тілами.
Перший закон термодинаміки є узагальненням дослідних фактів. Згідно з цим законом, енергія не може бути створена або знищена; вона передається від однієї системи до іншої і перетворюється з однієї форми в іншу. Важливим наслідком першого закону термодинаміки є твердження про неможливість створення машини, здатної здійснювати корисну роботу без споживання енергії ззовні і без яких-небудь змін усередині самої машини. Така гіпотетична машина дістала назву вічного двигуна (perpetuum mobile) першого роду. Численні спроби створити таку машину незмінно закінчувалися провалом. Будь-яка машина може здійснювати позитивну роботу A над зовнішніми тілами тільки за рахунок отримання деякої кількості теплоти Q від навколишніх тіл або зменшення ΔU своєї внутрішньої енергії.
Застосуємо перший закон термодинаміки до изопроцессам в газах.
У ізохорному процесі (V = const) газ роботи не здійснює, A = 0. Отже,
Q = ΔU = U (T2) - U (T1).
Тут U (T1) і U (T2) - внутрішні енергії газу в початковому і кінцевому станах. Внутрішня енергія ідеального газу залежить тільки від температури (закон Джоуля). При ізохорному нагріванні тепло поглинається газом (Q > 0), і його внутрішня енергія збільшується. При охолодженні тепло віддається зовнішнім тілам (Q < 0).
У ізобарному процесі (p = const) робота, що здійснюється газом, виражається співвідношенням
A = p (V2 - V1) = p ΔV.
Перший закон термодинаміки для ізобарного процесу:
Q = U (T2) - U (T1) + p (V2 - V1) = ΔU + pΔV.
При ізобарному розширенні Q > 0 - тепло поглинається газом, і газ здійснює позитивну роботу. При ізобарному стискуванні Q < 0 - тепло віддається зовнішнім тілам. В цьому випадку A < 0. Температура газу при ізобарному стискуванні зменшується, T2 < T1; внутрішня енергія убуває, ΔU < 0.
У ізотермічному процесі температура газу не змінюється, отже, не змінюється і внутрішня енергія газу, ΔU = 0.
Перший закон термодинаміки для ізотермічного процесу виражається співвідношенням
Q = A.
Кількість теплоти Q, отриманої газом в процесі ізотермічного розширення, перетворюється на роботу над зовнішніми тілами. При ізотермічному стискуванні робота зовнішніх сил, вироблена над газом, перетворюється на тепло, яке передається навколишнім тілам.
Разом з ізохорним, ізобарним і ізотермічним процесами в термодинаміці часто розглядаються процеси, що протікають у відсутність теплообміну з навколишніми тілами. Посудини з теплонепроникними стінками називаються адіабатичними оболонками, а процеси розширення або стискування газу в таких посудинах називаються адіабатичними.
У адіабатичному процесі Q = 0; тому перший закон термодинаміки набирає вигляду
A = -ΔU
тобто газ здійснює роботу за рахунок спаду його внутрішньої енергії.
На площі (p, V) процес адіабатичного розширення (чи стискування) газу зображається кривою, яка називається адіабатою. При адіабатичному розширенні газ здійснює позитивну роботу (A > 0); тому його внутрішня енергія зменшується (ΔU < 0). Це призводить до пониження температури газу. Внаслідок цього тиск газу при адіабатичному розширенні убуває швидше, ніж при ізотермічному (мал. 5).
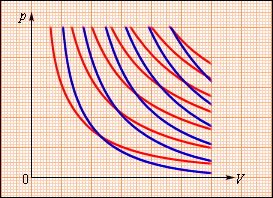
Малюнок 5.
У термодинаміці виводиться рівняння адіабатичного процесу для ідеального газу. У координатах (p, V) це рівняння має вигляд
pVγ = const.
Це співвідношення називають рівнянням Пуассона. Тут γ = Cp / CV - показник адіабати, Cp і CV - теплоємності газу в процесах з постійним тиском і з постійним об'ємом.
Робота газу в адіабатичному процесі просто виражається через температури T1 і T2 початкового і кінцевого станів:
A = CV (T2 - T1).
Адіабатичний процес також можна віднести до изопроцессам. У термодинаміці важливу роль грає фізична величина, яка називається ентропією Зміна ентропії в якому-небудь квазістатичному процесі рівно приведеному теплу ΔQ / T, отриманому системою. Оскільки на будь-якій ділянці адіабатичного процесу ΔQ = 0, ентропія в цьому процесі залишається незмінною.
Адіабатичний процес (так само, як і інші изопроцессы) є процесом квазістатичним. Усі проміжні стани газу в цьому процесі близькі до станів термодинамічної рівноваги Будь-яка точка на адіабаті описує рівноважний стан.
Не всякий процес, проведений в адіабатичній оболонці, тобто без теплообміну з навколишніми тілами, задовольняє цій умові. Прикладом неквазистатического процесу, в якому проміжні стани нерівноважні, може служити розширення газу в порожнечу. На мал. зображена жорстка адіабатична оболонка, що складається з двох сполучених посудин, розділених вентилем K. У первинному стані газ заповнює одну з посудин, а в іншій посудині - вакуум. Після відкриття вентиля газ розширюється, заповнює обидві посудини, і встановлюється новий рівноважний стан. У цьому процесі Q = 0, оскільки немає теплообміну з навколишніми тілами, і A = 0, оскільки оболонка недеформируема. З першого закону термодинаміки виходить: ΔU = 0, тобто внутрішня енергія газу залишилася незмінною. Оскільки внутрішня енергія ідеального газу залежить тільки від температури, температура газу в початковому і кінцевому станах однакова - точки на площини (p, V), що зображують ці стани, лежать на одній ізотермі. Усі проміжні стани газу нерівноважні і їх не можна зображувати на діаграмі.
Розширення газу в порожнечу - приклад безповоротного процесу. Його не можна провести в протилежному напрямі.
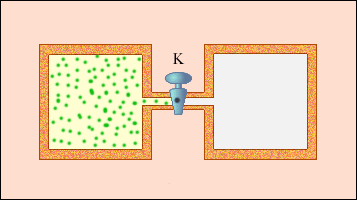
Якщо в результаті теплообміну тілу передається деяка кількість теплоти, то внутрішня енергія тіла і його температура змінюються. Кількість теплоти Q, необхідна для нагрівання 1 кг речовини на 1 Дж називають питомою теплоємністю речовини c.
c = Q / (mΔT).
У багатьох випадках зручно використовувати молярну теплоємність C:
C = M · c
де M - молярна маса речовини.
Визначена таким чином теплоємність не є однозначною характеристикою речовини. Згідно з першим законом термодинаміки зміна внутрішньої енергії тіла залежить не лише від отриманої кількості теплоти, але і від роботи, здійсненої тілом. Залежно від умов, при яких здійснювався процес теплопередачі, тіло могло здійснювати різну роботу. Тому однакова кількість теплоти, передана тілу, могла викликати різні зміни його внутрішньої енергії і, отже, температури.
Така неоднозначність визначення теплоємності характерна тільки для газоподібної речовини. При нагріванні рідких і твердих тіл їх об'єм практично не змінюється, і робота розширення виявляється рівною нулю. Тому уся кількість теплоти, отримана тілом, йде на зміну його внутрішньої енергії. На відміну від рідин і твердих тіл, газ в процесі теплопередачі може сильно змінювати свій об'єм і здійснювати роботу. Тому теплоємність газоподібної речовини залежить від характеру термодинамічного процесу. Зазвичай розглядаються два значення теплоємності газів: CV - молярна теплоємність в ізохорному процесі (V = const) і Cp - молярна теплоємність в ізобарному процесі (p = const).
У процесі при постійному об'ємі газ роботи не здійснює: A = 0. З першого закону термодинаміки для 1 моля газу слідує
QV = CV ΔT = ΔU.
Зміна ΔU внутрішньої енергії газу прямо пропорціонально зміні ΔT його температури.
Для процесу при постійному тиску перший закон термодинаміки дає:
Qp = ΔU + p (V2 - V1) = CVΔT + pΔV
де ΔV - зміна об'єму 1 моля ідеального газу при зміні його температури на ΔT. Звідси слідує:
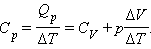
Відношення ΔV / ΔT може бути знайдене з рівняння стану ідеального газу:
pV = RT
де R - універсальна газова постійна. При p = const
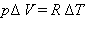
Таким чином, співвідношення, що виражає зв'язок між молярними теплоемностями Cp і CV, має вигляд (формула Майєра):
Cp = CV + R.
Молярна теплоємність Cp газу в процесі з постійним тиском завжди більше молярної теплоємності CV в процесі з постійним об'ємом (мал. 6).
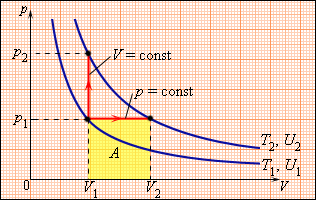
Малюнок 6.
Два можливі процеси нагрівання газу на ΔT = T2 - T1. При p = const газ здійснює роботу A = p1(V2 - V1). Тому Cp > CV
Відношення теплоемностей в процесах з постійним тиском і постійним об'ємом грає важливу роль в термодинаміці. Воно позначається грецькою буквою γ.
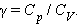
Зокрема, це відношення входить у формулу для адіабатичного процесу
Між двома ізотермами з температурами T1 і T2 на діаграмі (p, V) можливі різні шляхи переходу. Оскільки для усіх таких переходів зміна температури ΔT = T2 - T1 однаково, отже, однакова зміна ΔU внутрішньої енергії. Проте, досконалі при цьому роботи A і отримані в результаті теплообміну кількості теплоти Q виявляться різними для різних шляхів переходу. Звідси витікає, що у газу є незліченна кількість теплоемкостей. Cp і CV - це лише приватні (і дуже важливі для теорії газів) значення теплоемкостей.
Термодинамічні процеси, в яких теплоємність газу залишається незмінною, називаються політропічними. Усі изопроцессы є політропічними. У разі ізотермічного процесу ΔT = 0, тому CT = ∞. В адіабатичному процесі ΔQ = 0, отже, Cад = 0.
Слід зазначити, що "теплоємність", як і "кількість теплоти" - украй невдалі терміни. Вони дісталися сучасній науці в спадок від теорії теплорода, що панувала в XVIII столітті. Ця теорія розглядала теплоту як особливу невагому речовину, що міститься в тілах. Вважалося, що воно не може бути ні створено, ні знищено. Нагрівання тіл пояснювалося збільшенням, а охолодження - зменшенням що міститься усередині них теплорода. Теорія теплорода неспроможна. Вона не може пояснити, чому одну і ту ж зміну внутрішньої енергії тіла можна отримати, передаючи йому різну кількість теплоти залежно від роботи, яку здійснює тіло. Тому позбавлено фізичного сенсу твердження, що "в цьому тілі знаходиться такий-то запас теплоти".
У молекулярно-кінетичній теорії встановлюється наступне співвідношення між середньою кінетичною енергією поступального руху молекул і абсолютною температурою T:
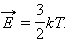
Внутрішня енергія 1 моля ідеального газу дорівнює:
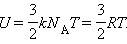
При зміні температури на ΔT внутрішня енергія змінюється на величину
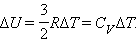
Коефіцієнт пропорційності між ΔU іΔT дорівнює теплоємності CV при постійномутиску:
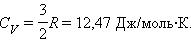
Це співвідношення добре підтверджується в експериментах з газами, що складаються з одноатомних молекул (гелій, неон, аргон). Проте, для двоатомних (водень, азот) і багатоатомних (вуглекислий газ) газів це співвідношення не узгоджується з експериментальними даними. Причина такої розбіжності полягає в тому, що для двух- і багатоатомних молекул середня кінетична енергія повинна включати енергію не лише поступального, але і обертального руху молекул.

Малюнок 7.
Модель двоатомної молекули. Точка O співпадає з центром мас молекули
На мал. 7зображена модель двоатомної молекули. Молекула може здійснювати п'ять незалежних рухів: три поступальних ходи уздовж осей X, Y, Z і два обертання відносно осей X і Y. Досвід показує, що обертання відносно осі Z, на якій лежать центри обох атомів, може бути збуджене тільки при дуже високих температурах. При звичайних температурах обертання біля осі Z не відбувається, так само як не обертається одноатомна молекула. Кожен незалежний рух називається ступенем свободи. Таким чином, одноатомна молекула має 3 поступальні ступені свободи, "жорстка" двоатомна молекула має 5 мір (3 поступальні і 2 обертальні), а багатоатомну молекулу - 6 ступенів свободи (3 поступальні і 3 обертальні).
У класичній статистичній фізиці доводиться так звана теорема про рівномірний розподіл енергії по ступенях свободи:
Якщо система молекул знаходиться в тепловій рівновазі при температурі T, то середня кінетична енергія рівномірно розподілена між усіма ступенями свободи і для кожного ступеня свободи молекули вона рівна.
З цієї теореми виходить, що молярні теплоємності газу Cp і CV і їх відношення γ можуть бути записані у виді
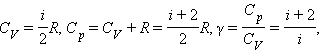
де i - число ступенів свободи газу.
Для газу, що складається з одноатомних молекул (i = 3)
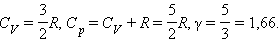
Для газу, що складається з двоатомних молекул (i = 5)
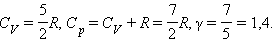
Для газу, що складається з багатоатомних молекул (i = 6)
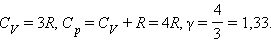
Експериментально виміряні теплоємності багатьох газів за звичайних умов досить добре узгоджуються з приведеними виразами. Проте, в цілому класична теорія теплоємності газів не може вважатися цілком задовільною. Існує багато прикладів значних розбіжностей між теорією і експериментом. Це пояснюється тим, що класична теорія не в змозі повністю врахувати енергію, пов'язану з внутрішніми рухами в молекулі.
Теорему про рівномірний розподіл енергії по ступенях свободи можна застосувати і до теплового руху часток в твердому тілі. Атоми, що входять до складу кристалічної решітки, здійснюють коливання біля положень рівноваги. Енергія цих коливань і є внутрішньою енергією твердого тіла. Кожен атом в кристалічній решітці може коливатися в трьох взаємно перпендикулярних напрямах. Отже, кожен атом має 3 коливальні ступені свободи. При гармонійних коливаннях середня кінетична енергія дорівнює середній потенційній енергії. Тому відповідно до теореми про рівномірний розподіл на кожен коливальний ступінь свободи доводиться середня енергія kT, а на один атом - 3kT. Внутрішня енергія 1 моля твердої речовини рівна:
U = 3NАkT = 3RT.
Тому молярна теплоємність речовини в твердому стані рівна:
C = 3R = 25,12 Дж/міль·К.
Це співвідношення називається законом Дюлонга-Пти. Для твердих тіл практично не існує відмінності між Cp і CV через нікчемно малу роботу при розширенні або стискуванні.
Досвід показує, що у багатьох твердих тіл (хімічних елементів) молярна теплоємність при звичайних температурах дійсно близька до 3R. Проте, при низьких температурах спостерігаються значні розбіжності між теорією і експериментом. Це показує, що гіпотеза про рівномірний розподіл енергії по ступенях свободи є наближенням. Спостережувана на досвіді залежність теплоємності від температури може бути пояснена тільки на основі квантових представлень.
Тепловим двигуном називається пристрій, здатний перетворювати отриману кількість теплоти на механічну роботу. Механічна робота в теплових двигунах виконується в процесі розширення деякої речовини, яке називається робочим тілом. Як робоче тіло зазвичай використовуються газоподібні речовини (пари бензину, повітря, водяна пара). Робоче тіло отримує (чи віддає) теплову енергію в процесі теплообміну з тілами, що мають великий запас внутрішньої енергії. Ці тіла називаються тепловими резервуарами.
Як випливає з першого закону термодинаміки, отримана газом кількість теплоти Q повністю перетворюється на роботу A при ізотермічному процесі, при якому внутрішня енергія залишається незмінною (ΔU = 0),:
A = Q.
Але такий одноразовий акт перетворення теплоти в роботу не представляє інтересу для техніки. Реально існуючі теплові двигуни (парові машини, двигуни внутрішнього згорання і т. д.) працюють циклічно. Процес теплопередачі і перетворення отриманої кількості теплоти в роботу періодично повторюється. Для цього робоче тіло повинне здійснювати круговий процес або термодинамічний цикл, при якому періодично відновлюється початковий стан. Кругові процеси зображаються на діаграмі (p, V) газоподібного робочого тіла за допомогою замкнутих кривих (мал. 8). При розширенні газ здійснює позитивну роботу A1, рівну площі під кривою abc, при стискуванні газ здійснює негативну роботу A2, рівну по модулю площі під кривою cda. Повна робота за цикл A = A1 + A2 на діаграмі (p, V) дорівнює площі циклу. Робота A позитивна, якщо цикл обходиться за годинниковою стрілкою, і A негативна, якщо цикл обходиться в протилежному напрямі.
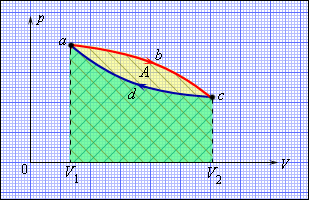
Малюнок 8.
Круговий процес на діаграмі (p, V). abc - крива розширення, cda - крива стискування. Робота A в круговому процесі дорівнює площі фігури abcd
Загальна властивість усіх кругових процесів полягає в тому, що їх неможливо провести, приводячи робоче тіло в тепловий контакт тільки з одним тепловим резервуаром. Їх треба, принаймні, два. Тепловий резервуар з вищою температурою називають нагрівачем, а з нижчою - холодильником. Здійснюючи круговий процес, робоче тіло отримує від нагрівача деяку кількість теплоти Q1 > 0 і віддає холодильнику кількість теплоти Q2 < 0. Повна кількість теплоти Q, отримана робочим тілом за цикл, рівна
Q = Q1 + Q2 = Q1 - |Q2|.
При обході циклу робоче тіло повертається в первинний стан, отже, зміна його внутрішньої енергії дорівнює нулю (ΔU = 0). Згідно з першим законом термодинаміки,
ΔU = Q - A = 0.
Звідси слідує:
A = Q = Q1 - |Q2|.
Робота A, що здійснюється робочим тілом за цикл, дорівнює отриманій за цикл кількості теплоти Q. Відношення роботи A до кількості теплоти Q1, отриманої робочим тілом за цикл від нагрівача, називається коефіцієнтом корисної дії η теплової машини:
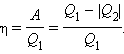
Коефіцієнт корисної дії вказує, яка частина теплової енергії, отриманої робочим тілом від "гарячого" теплового резервуару, перетворилася на корисну роботу. Інша частина (1 - η) була "марно" передана холодильнику. Коефіцієнт корисної дії теплової машини завжди менше одиниці (η < 1). Енергетична схема теплової машини зображена на мал. 9.
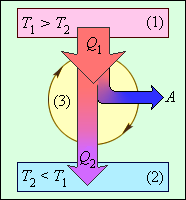
Малюнок 9.
Енергетична схема теплової машини: 1 - нагрівач; 2 - холодильник; 3 - робоче тіло, що здійснює круговий процес. Q1 > 0, A > 0, Q2 < 0; T1 > T2
У двигунах, вживаних в техніці, використовуються різні кругові процеси. На мал. 10 зображені цикли, використовувані в бензиновому карбюраторному і в дизельному двигунах. У обох випадках робочим тілом є суміш пари бензину або дизельного палива з повітрям. Цикл карбюраторного двигуна внутрішнього згорання складається з двох ізохор (1-2, 3-4) і двох адіабат (2-3, 4-1). Дизельний двигун внутрішнього згорання працює по циклу, що складається з двох адіабат (1-2, 3-4), однієї ізобари (2-3) і однієї ізохори (4-1). Реальний коефіцієнт корисної дії у карбюраторного двигуна близько 30 %, у дизельного двигуна - близько 40 %.
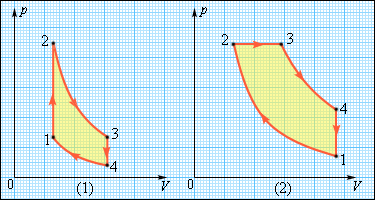
Малюнок 10.
Цикли карбюраторного двигуна внутрішнього згорання і дизельного двигуна (2)
У 1824 році французький інженер С. Карно розглянув круговий процес, що складається з двох ізотерм і двох адіабат, який зіграв важливу роль в розвитку вчення про теплові процеси. Він називається циклом Карно (мал. 11).

Малюнок 11.
Цикл Карно
Цикл Карно здійснює газ, що знаходиться в циліндрі під поршнем. На ізотермічній ділянці (1-2) газ приводиться в тепловий контакт з гарячим тепловим резервуаром (нагрівачем), що має температуру T1. Газ ізотермічно розширюється, здійснюючи роботу A12, при цьому до газу підводиться деяка кількість теплоти Q1 = A12. Далі на адіабатичній ділянці (2-3) газ поміщається в адіабатичну оболонку і продовжує розширюватися у відсутність теплообміну. На цій ділянці газ здійснює роботу A23 > 0. Температура газу при адіабатичному розширенні падає до значення T2. На наступній ізотермічній ділянці (3-4) газ приводиться в тепловий контакт з холодним тепловим резервуаром (холодильником) при температурі T2 < T1. Відбувається процес ізотермічного стискування. Газ здійснює роботу A34 < 0 і віддає тепло Q2 < 0, рівне виконаній роботі A34. Внутрішня енергія газу не змінюється. Нарешті, на останній ділянці адіабатичного стискування газ знову поміщається в адіабатичну оболонку. При стискуванні температура газу підвищується до значення T1, газ здійснює роботу A41 < 0. Повна робота A, що здійснюється газом за цикл, дорівнює сумі робіт на окремих ділянках:
A = A12 + A23 + A34 + A41.
На діаграмі (p, V) ця робота дорівнює площі циклу.
Процеси на усіх ділянках циклу Карно передбачаються квазістатичними. Зокрема, обидві ізотермічні ділянки (1-2 і 3-4) проводяться при нескінченно малій різниці температур між робочим тілом (газом) і тепловим резервуаром (нагрівачем або холодильником).
Як випливає з першого закону термодинаміки, робота газу при адіабатичному розширенні (чи стискуванні) дорівнює спаду ΔU його внутрішньої енергії. Для 1 моля газу
A = -ΔU = - CV (T2 - T1)
де T1 і T2 - початкова і кінцева температури газу.
Звідси витікає, що роботи, здійснені газом на двох адіабатичних ділянках циклу Карно, однакові по модулю і протилежні по знаках
A23 = - A41.
За визначенням, коефіцієнт корисної дії η циклу Карно є
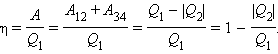
С. Карно виразив коефіцієнт корисної дії циклу через температури нагрівача T1 і холодильника T2:
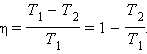
Цикл Карно чудовий тим, що на усіх його ділянках відсутнє зіткнення тіл з різними температурами. Будь-який стан робочого тіла (газу) на циклі є квазірівноважним, тобто нескінченно близьким до стану теплової рівноваги з навколишніми тілами (тепловими резервуарами або термостатами). Цикл Карно виключає теплообмін при кінцевій різниці температур робочого тіла і довкілля (термостатів), коли тепло може передаватися без здійснення роботи. Тому цикл Карно - найбільш ефективний круговий процес з усіх можливих при заданих температурах нагрівача і холодильника:
ηКарно = ηmax.
Будь-яка ділянка циклу Карно і увесь цикл в цілому може бути пройдена в обох напрямах. Обхід циклу за годинниковою стрілкою відповідає тепловому двигуну, коли отримане робочим тілом тепло частково перетворюється на корисну роботу. Обхід проти годинникової стрілки відповідає холодильній машині, коли деяка кількість теплоти відбирається від холодного резервуару і передається гарячому резервуару за рахунок здійснення зовнішньої роботи. Тому ідеальний пристрій, що працює по циклу Карно, називають оборотною тепловою машиною.
У реальних холодильних машинах використовуються різні циклічні процеси. Усі холодильні цикли на діаграмі (p, V) обходяться проти годинникової стрілки. Енергетична схема холодильної машини представлена на мал. 12.
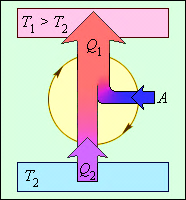
Малюнок 12.
Енергетична схема холодильної машини. Q1 < 0, A < 0, Q2 > 0, T1 > T2
Пристрій, що працює по холодильному циклу, може мати двояке призначення. Якщо корисним ефектом є відбір деякої кількості тепла |Q2| від охолоджуваних тіл (наприклад, від продуктів в камері холодильника), то такий пристрій є звичайним холодильником. Ефективність роботи холодильника можна охарактеризувати відношенням
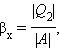
тобто эфективность роботи холодильника - це кількість тепла, що відбирається від охолоджуваних тіл на 1 джоуль витраченої роботи. При такому визначенні βх може бути і більше, і менше одиниці. Для оберненого циклу Карно
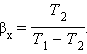
Якщо корисним ефектом є передача деякої кількості тепла |Q1| тілам (наприклад, повітрю в приміщенні), що нагріваються, то такий пристрій називається тепловим насосом. Ефективність βТ теплового насоса може бути визначена як відношення
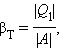
З першого закону термодинаміки виходить:
|Q1| > |A|
отже, βТ завжди більше одиниці. Для оберненого циклу Карно
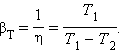
Перший закон термодинаміки – закон збереження енергії для теплових процесів – встановлює зв'язок між кількістю теплоти Q, отриманої системою, зміноюΔU її внутрішньої енергії і роботою A, здійсненою над зовнішніми тілами,:
Q = ΔU + A.
Згідно з цим законом, енергія не може бути створена або знищена; вона передається від однієї системи до іншої і перетворюється з однієї форми в іншу. Процеси, що порушують перший закон термодинаміки, ніколи не спостерігалися. На мал. 13 зображені пристрої, заборонені першим законом термодинаміки.
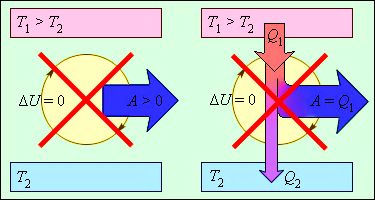
Малюнок 13.
Перший закон термодинаміки не встановлює напряму теплових процесів. Проте, як показує досвід, багато теплових процесів можуть протікати тільки в одному напрямі. Такі процеси називаються безповоротними. Наприклад, при тепловому контакті двох тіл з різними температурами тепловий потік завжди спрямований від теплішого тіла до холоднішого. Ніколи не спостерігається мимовільний процес передачі тепла від тіла з низькою температурою до тіла з вищою температурою. Отже, процес теплообміну при кінцевій різниці температур є безповоротним.
Оборотними процесами називають процеси переходу системи з одного рівноважного стану в інше, які можна провести у зворотному напрямі через ту ж послідовність проміжних рівноважних станів. При цьому сама система і навколишні тіла повертаються до початкового стану.
Процеси, в ході яких система увесь час залишається в стані рівноваги, називаються квазістатичними. Усі квазістатичні процеси обратимы. Усі оборотні процеси є квазістатичними.
Якщо робоче тіло теплової машини приводиться в контакт з тепловим резервуаром, температура якого в процесі теплообміну залишається незмінною, то єдиним оборотним процесом буде ізотермічний квазістатичний процес, що протікає при нескінченно малій різниці температур робочого тіла і резервуару. За наявності двох теплових резервуарів з різними температурами оборотним шляхом можна провести процеси на двох ізотермічних ділянках. Оскільки адіабатичний процес також можна проводити в обох напрямах (адіабатичне стискування і адіабатичне розширення), то круговий процес, що складається з двох ізотерм і двох адіабат (цикл Карно) є єдиним оборотним круговим процесом, при якому робоче тіло приводиться в тепловий контакт тільки з двома тепловими резервуарами. Усі інші кругові процеси, що проводяться з двома тепловими резервуарами, необратимы.
Процеси перетворення механічної роботи у внутрішню енергію тіла є безповоротними із-за наявності тертя, процесів дифузії в газах і рідинах, процеси перемішування газу за наявності початкової різниці тисків і т. д. Усі реальні процеси необратимы, але вони можуть скільки завгодно близько наближатися до оборотних процесів. Оборотні процеси є ідеалізацією реальних процесів.
Другий закон термодинаміки безпосередньо пов'язаний з безповоротністю реальних теплових процесів. Енергія теплового руху молекул якісно відрізняється від усіх інших видів енергії - механічної, електричної, хімічної і т. д. Енергія будь-якого виду, окрім енергії теплового руху молекул, може повністю перетворитися на будь-який інший вид енергії, у тому числі і в енергію теплового руху. Остання може випробувати перетворення на будь-який інший вид енергії лише частково. Тому будь-який фізичний процес, в якому відбувається перетворення якого-небудь виду енергії на енергію теплового руху молекул, є безповоротним процесом, тобто він не може бути здійснений повністю у зворотному напрямі.
Загальною властивістю усіх безповоротних процесів є те, що вони протікають в термодинамічно нерівноважній системі і в результаті цих процесів замкнута система наближається до стану термодинамічної рівноваги.
На підставі будь-якого з формулювань другого закону термодинаміки можуть бути доведені наступні твердження, які називаються теоремами Карно,:
Коефіцієнт корисної дії теплової машини, що працює при цих значеннях температур нагрівача і холодильника, не може бути більше, ніж коефіцієнт корисної дії машини, що працює по оборотному циклу Карно при тих же значеннях температур нагрівача і холодильника.
Коефіцієнт корисної дії теплової машини, що працює по циклу Карно, не залежить від роду робочого тіла, а тільки від температур нагрівача і холодильника.
Таким чином, коефіцієнт корисної дії машини, що працює по циклу Карно, максимальний.
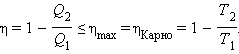
Знак рівності в цьому співвідношенні відповідає оборотним циклам. Для машин, що працюють по циклу Карно, це співвідношення може бути переписане у виді

У якому б напрямі не обходився цикл Карно (по або проти годинникової стрілки) величини Q1 і Q2 завжди мають різні знаки. Тому можна записати

Це співвідношення може бути узагальнене на будь-який замкнутий оборотний процес, який можна представити як послідовність малих ізотермічних і адіабатичних ділянок (мал. 14).
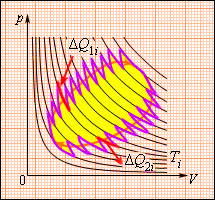
Малюнок 14.
При повному обході замкнутого оборотного циклу

де ΔQi = ΔQ1i + ΔQ2i - кількість теплоти, отримана робочим тілом на двох ізотермічних ділянках при температурі Ti. Для того, щоб такий складний цикл провести оборотним шляхом, потрібне робоче тіло приводити в тепловий контакт з багатьма тепловими резервуарами з температурами Ti. Відношення ΔQi / Ti називається приведеним теплом. Отримана формула показує, що повне приведене тепло на будь-якому оборотному циклі дорівнює нулю. Ця формула дозволяє ввести нову фізичну величину, яка називається ентропією і позначається буквою S (Р. Клаузіус, 1865 р
Запитання для самоперевірки:
1 Чим відрізняється робота, що виконується зовнішніми тілами над газом, від роботи газу над зовнішніми тілами?
2 Чи виконується робота у процесі ізобарного стиснення або розширення газу?
3 Поясніть, як графічно визначають роботу ізобарного розширення газу?
4 Чому дорівнює робота газу під час ізохорного процесу?
5 Поясніть, як графічно визначають роботу ізотермічного розширення газу.
6 Як формулюють закон збереження енергії?
7 У чому полягає еквівалентність кількості теплоти, механічної роботи, затраченої енергії?
8 Як записують і формулюють перший закон термодинаміки?
9 Як записується перший закон термодинаміки для ізотермічного, ізохорного, ізобарного й адіабатного процесів?
10 Який процес називають адіабатним? За яких умов він здійснюється? Наведіть приклади адіабатних процесів.
11 Який процес називають циклічним? Оборотним?
12 У чому полягає фізичний зміст другого закону термодинаміки? Як формулюють цей закон?
13 Що називають тепловим двигуном?
14 Що називають нагрівником, холодильником? Яка їх роль у роботі теплового двигуна?
15 Що називають робочим тілом? Які речовини використовують як робоче тіло двигуна? За якою формулою визначають роботу, виконану двигуном?
16 Що називають ККД теплового двигуна?
17 Запишіть і поясніть формулу ККД теплового двигуна.
18 За якою формулою визначають ККД ідеальної теплової машини (ККД машини Карно)?
19 Який ККД паросилових установок і двигунів внутрішнього згоряння?
20 Опишіть робочий цикл холодильної машини.
21 З яких блоків складається побутовий холодильник?
22 Чому зовнішній теплообмінник вашого холодильника нагрівається?
Тема 6.1: Електричне поле та його властивості.(2 год.)
Мета: формування у студентів уявлень про електричне поле, взаємодію заряджених тіл, існування двох видів електричних зарядів, з`ясування сутності процесу електризації тіл; сприяти формуванню вмінь логічно мислити, аналізувати, визначати електричні явища в природі і техніці; розвиток інтересу до науки.
План.
1) Електричний заряд. Закон Кулона.
2) Електричне поле, принцип суперпозиції полів.
3) Напруженість електричного поля. Лінії напруженості.
4) Робота поля. Потенціал.
Дата публикования: 2015-09-17; Прочитано: 2647 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
