 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Вивчення нового матеріалу. Твердими називають такі тіла, які зберігають об'єм і форму навіть під час
|
|
Твердими називають такі тіла, які зберігають об'єм і форму навіть під час
дії на них інших тіл (сил). Причиною такої стійкості є характер руху і взаємодії
молекул: вони не можуть змінювати положення своєї рівноваги, здійснюючи малі коливання і обертаючись навколо нього. Енергія і амплітуда коливань тим більша, чим вища температура тіла.
За впорядкованістю положення рівноваги тверді тіла поділяють на кристали і аморфні тіла.
Більшість твердих тіл є кристалічними. 100 мільйонів років тому шари, близькі до поверхні нашої планети, затверділи й утворили земну кору. Саме в той час й утворились більшість представлених тут кристалів, подібно до льоду при замерзанні води. Слово «кристал» в перекладі з грецької – лід. Щоправда, спочатку так називали кварци, вважаючи що ці напівпрозорі кристали утворились з води в суворих умовах гірських вершин Альп. Надалі й всі тверді правильні природні утворення стали називати «кристалами».
Як розміщені в них атоми?
Ще в 1912 році дослідженнями за допомогою рентгенівських променів було доведено, щоатоми і молекули кристалів розміщені в певному порядку.
Кристали - це тверді тіла, в яких атоми або молекули розміщені впорядковано і утворюють періодично повторювану внутрішню структуру. Можна виділити маленький об'єм (елементарну комірку), завдяки якій можна побудувати весь кристал, як будинок із цегли. Елементарна комірка може мати форму куба, паралелепіпеда, призми тощо. Правильна геометрична форма є істотною зовнішньою ознакою будь-якого кристала в природних умовах (візерунки на вікнах під час морозу, правильні форми сніжинок, кристалів кухонної солі, гірського кришталю тощо).
Кристали однієї і тієї самої речовини можуть мати різну форму, яка залежить від умов їх утворення; вони можуть відрізнятися і кольором. Іноді весь шматок твердої речовини може становити один кристал. Такими є, наприклад, шматочки цукру в цукровому піску, шматочки солі, гірського кришталю тощо. Усе це окремі кристали, їх називають монокристалами.
Фізичнівластивостімонокристалів:
1. Геометрична форма (правильна).
2. Постійна температура плавлення.
3. Анізотропія.
Анізотропія - цезалежністьфізичнихвластивостейвіднапрямкувсерединікристалу.
Видианізотропії:
а) Механічна.
б) Оптична.
в) Електрична.
Тіло, яке складається з безлічі невпорядковано розміщених кристалів, називають полікристалічними або полікристалом ("морозні візерунки" на вікнах, цукор рафінад, метали тощо).
Фізичнівластивостіполікристалів:
1. Геометрична форма (неправильна).
2. Постійна температура плавлення.
3. Ізотропія.
Ізотропія – однаковістьфізичнихвластивостей в усіхнапрямках.
У твердих речовинах частинки розташовані у просторі суворо закономірно для кожної речовини. Щоб якось уявити цю закономірність, у тривимірному просторі подумки об'єднуємо центри молекул прямими лініями, які перетинаються. При цьомуутвориться просторовий каркас, який називають кристалічними ґратками.
Отже, кристалічна гратка - це впорядковане розміщення атомів.
Місця, в яких лінії перетинаються, називають вузлами кристалічних ґраток.
Елементарна комірка може мати форму куба, паралелепіпеда, призми тощо (мал.)
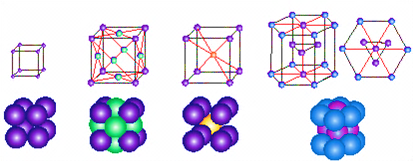 Типи кристалічних граток
Типи кристалічних граток
Вузол кристалічної гратки – точка, відносно якої атом (молекула) здійснює коливання. Залежно від природи частинок, щомістяться у вузлах кристалічних ґраток, розрізняють йонні, атомні, молекулярні та металеві кристалічні ґратки.
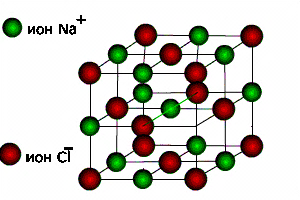
Йонні кристалічні ґратки. Типовим представником сполук з йонним типом кристалічних ґраток є натрій хлорид NaCl. Його кристалічні ґратки утворені йонами НатріюNa+ та йонами Хлору Сl-, які почергово розміщуються у вузлах ґраток.Иони утримуються один з одним силами притягання, і кристалл солі є ніби єдиним цілим.Такі кристали мають значну міцність.
Атомні кристалічні ґратки. У вузлах атомних кристалічних ґраток містяться окремі атоми, сполучені між собою ковалентними зв'язками. Такі кристалічні ґратки має алмаз. У його кристалі кожний атом Карбону сполучений ковалентними зв'язками з чотирма сусідніми атомами Карбону, тобто утворює чотири спільні електронні пари. Ось чому можна говорити, що Карбон — чотиривалентний елемент.
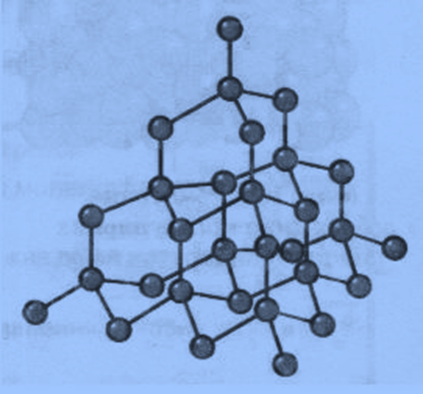
Алмаз та інші речовини, які мають атомні кристалічні ґратки, характеризуються великою твердістю, дуже високими температурами плавлення і кипіння, вони практично не розчиняються в жодних розчинниках, не проводять електричний струм, оскільки вільних електронів немає, всі 4 валентні електрони беруть участь в утворенні ковалентних зв’язків.
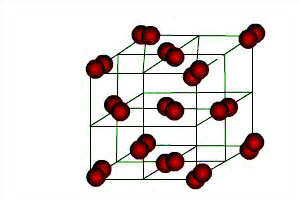
Молекулярні кристалічні ґратки. У вузлах молекулярних кристалічних ґраток містяться молекули як неполярні, так і полярні. Наприклад, у вузлах кристалічних ґраток йоду містяться молекули йоду.Сили міжмолекулярної взаємодії, так звані сили Ван-дер-Ваальса, значно слабкіші за сили ковалентного зв'язку. Тому речовини з молекулярними ґратками мають невелику твердість, вони легкоплавкі і леткі. До таких речовин належать, наприклад, йод, нафталін, бром, вода, спирт, хлор, амоніакNH3, метан СН4, «сухийлід».
Металічні кристалічні гратки. У вузлах кристалічних грат розміщені позитивні йони металу, між якими рухаються так звані вільні (валентні) електрони, що утворюють електронний газ.Зв’язок у металевих кристалах забезпечують сили притягання між позитивними йонами, розміщеними у вузлах грат, і негативним електронним газом. Ці сили притягання зрівноважуються силами відштовхування, які діють між однойменними йонами. Таку кристалічну гратку мають всі метали.
У вченні про будову твердих тіл важливу роль відіграє поняття про їх симетрію. Під симетрією кристалів розуміють закономірність, яка спостерігається у положенні їх частин на площині та в просторі. Кристалічні ґратки здебільшого мають одночасно кілька видів симетрії.
Проте не кожне поєднання елементів симетрії виявляється можливим. Існує обмежена кількість, а саме: 32 можливих комбінації площин та осей симетрії і відповідно 32 класи симетрії кристалів.
Багато властивостей кристалів і передусім їх механічні та електричні властивості дуже чутливі до дефектів у кристалічних ґратках, а також наявності в них навіть мізерних кількостей домішок.
Дефекти реальних кристалів та їх структуру можна безпосередньо виявити за допомогою електронно-мікроскопічних і рентгенівських досліджень.
Практичне використання полімерів. Природні та штучні полімери відіграють велику роль у сучасній техніці. Без полімерів уже не може обійтися жодна галузь техніки, тим більше нової.
Полімери – основа гуми, лаків, фарб, клеїв, іонітів тощо. Завдяки введенню до полімерів домішок, можна створювати речовини з дуже цінними якостями: високою твердістю, легкістю, вогнестійкістю та ін.
Крім аморфного, відкрито ще один стан речовини з подвійною природою – і рідини, і твердого тіла – це так звані рідкі кристали, особливий стан деяких органічних речовин.
Для них характерна плинність і вони утворюють краплі. Однак їх краплі можуть мати не кулеподібну, а видовжену форму. Молекули у краплі розміщуються порядком, не властивим звичайним рідинам і твердим тілам. Якщо в твердих кристалах спостерігається дальній порядок розміщення частинок у трьох взаємно перпендикулярних напрямах, то в рідких – за одним напрямом (одновісний дальній порядок).
Існують рідкі кристали в певному інтервалі температур, різному для різних речовин. Під час нагрівання вони перетворюються в звичайну рідину, внаслідок охолодження стають твердими кристалами.
Розрізняють три основні типи рідких кристалів: смектичні, нематичні, холестеричні.
У нематичних рідких кристалах (від грец. «нема» – нитка) молекули схожі на нитки (мал.).

Мал. Нематичний тип рідкого кристалу.
У смектичних рідких кристалах (від грец. «смегма» – мило) рівень впорядкованості вищий. Молекули смектика згруповані у шари (мал.).

Мал.Смектичний тип рідкого кристалу.
Прикладом смектика є розчин мила у воді. Коли ми миємо з милом руки, то шари молекул мила легко ковзають один відносно одного і шкіри, забираючи з неї бруд і передаючи його воді.
У холестеричних кристалах молекули мають форму спіралі, крок якої залежить від температури (мал.).

Мал.Холестеричний тип рідкого кристалу.
Властивість холестеричних рідких кристалів змінювати колір у разі зміни температури використовують у медицині (для визначення ділянок тіла з підвищеною температурою) і в техніці (для перетворення невидимого й інфрачервоного проміння від нагрітих тіл у видиме зображення).
Практичне використання рідких кристалів. Найпопулярніше поле для використання рідких кристалів — рідкокристалічні дисплеї (мал.).




Мал. Рідкокристалічні дисплеї.
Рідкокристалічний дисплей (англ. liquidcrystaldisplay, LCD) — це електричний пристрій візуального відображення інформації, принцип дії якого ґрунтується на явищі поляризації світлового потоку.
З явищем поляризації ви детально ознайомитесь у 12 класі. Зазначимо, лише, що із відкриттям класу рідких речовин, довгі молекули яких чутливі до електромагнітного поля і здатні повертати площину поляризації світла, з'явилася можливість керувати поляризацією.
Рідкокристалічні дисплеї споживають невелику кількість енергії, тому вони знайшли широке застосування як в кишенькових пристроях (годинниках, мобільних телефонах, кишенькових комп'ютерах), так і в комп'ютерних моніторах, телевізорах тощо.
Крім цього, рідкі кристали застосовують при виготовленні термодавачів, детекторів НВЧ-випромінюваннятощо.Дотепер вивчено понад 3000 речовин, що утворюють рідкі кристали. До них належать речовини біологічного походження, наприклад, дезоксирибонуклеїнова кислота, що несе код спадкової інформації, і речовина мозку.
Подальші дослідження цих речовин не тільки розширять їх застосування в техніці, але й допоможуть проникнути в таємниці біологічних процесів.
Дата публикования: 2015-09-17; Прочитано: 2401 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
