 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Кислотно-основное титрование
|
|
2.5.1.1. Определение констант ионизации фосфорной
кислоты
Цель работы. Изучить особенности титрования трехосновной кислоты и освоить способ расчета констант ионизации по кривой потенциометрического титрования.
Вводная часть. Фосфорная кислота диссоциирует в водном растворе ступенчато: K 1 = 7,1·10-3, K 2 = 6,2·10-8, K 3 = 5,0·10-13. Соответствующие показатели констант диссоциации равны pK 1 = 2,15; pK 2 = 7,21; pK 3 = 12,3. При титровании ее щелочью реакция нейтрализации проходит ступенчато.
В начале титрования pH раствора определяется диссоциацией кислоты по первой ступени.
 . .
| (1) |
При титровании до первой точки эквивалентности в растворе образуется буферная смесь (H3PO4 + H2PO4-), и pH раствора равен:
 . .
| (2) |
В первой точке эквивалентности (ТЭ 1) образуется дигидрофосфат натрия, и pH раствора равен (pH кислой соли):
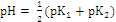 . .
| (3) |
Между первой и второй точкой эквивалентности в растворе существует буферная система (H2PO4- + HPO42-), pH которой равен:
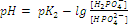 . .
| (4) |
Во второй точке эквивалентности (ТЭ 2) в растворе образуется гидрофосфат натрия; pH этого раствора рассчитывают по формуле:
 . .
| (5) |
В третьей точке эквивалентности (ТЭ 3) образуется средняя соль Na3PO4, которая подвергается гидролизу. pH раствора рассчитывают по формуле:
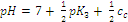 ,
где с с – концентрация Na3PO4. ,
где с с – концентрация Na3PO4.
| (6) |
Используя выражения (1) – (6), постройте ориентировочную кривую титрования 0,1 M NaOH.
Для удобства вычисления pK1 и pK2 целесообразно преобразовать выражение (2) и (4), заменив отношения концентраций соответствующими отношениями объемов титранта. Обозначим титранта в 1-й и 2-й ТЭ через VТЭ1 и VТЭ2. Если добавлено VТЭ1<V<V ТЭ 2 мл титранта концентрации с, то образовалось сV моль NaHPO 4 и осталось (сV ТЭ 1 -сV) моль H3PO 4. Отсюда выражение (2) принимает вид:
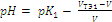 . .
| (7) |
В частности, если 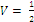 VТЭ1, то:
VТЭ1, то:
| pH = pK1. | (8) |
Выражение (4) преобразуется к виду:
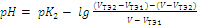 . .
| (9) |
pH раствора будет равен pK2, когда концентрации компонентов второй буферной смеси будут равны или когда прилито половина объема, требуемого для перехода от 1-й до 2-й ТЭ. (9). С целью более точного определения pK1 и pK2 следует замерить pH раствора для нескольких промежуточных объемов титранта. Значение pK3 можно оценить по формуле (5). Очевидно, что ошибка определения pK3 будет наибольшая.
Дата публикования: 2015-09-17; Прочитано: 813 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
