 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Кондуктометрическое титрование
|
|
Кондуктометрическое титрование основано на измерении электропроводности раствора, меняющейся в процессе химической реакции между исследуемым веществом и титрантом. Точку эквивалентности фиксируют по резкому излому кривой титрования.
Наиболее распространенными в практике кондуктометрического титрования являются реакции нейтрализации, осаждения, комплексообразования. Ниже приведены примеры кривых кондуктометрического титрования для некоторых типов реакций с применением слабых и сильных электролитов (рис.1.2 - 1.6).
1.3.2.1. Реакции нейтрализации.
При титровании кислот (оснований) основаниями (кислот) происходит замена высокоподвижных ионов гидроксония (гидроксидов) ионами с намного меньшей подвижностью, что приводит к резкому изменению электрической проводимости раствора в точке эквивалентности.
Титрование слабой кислоты слабым основанием в кондуктометрии не используются из-за слабо выраженного изменения электропроводности в растворе в процессе титрования. При титровании многоосновных кислот сильным основанием вид кривой аналогичен титрованию смеси сильной и слабой кислот. При этом результат титрования и ход кривой зависят от соотношения констант различных ступеней диссоциации.



|
1.3.2.2. Реакции осаждения
В процессе титрования по методу осаждения изменение электропроводности будет зависеть от соотношения подвижности ионов, участвующих в реакции. Чем меньше подвижность иона, который замещает в растворе реагирующий ион, тем острее угол на кривой титрования и тем точнее можно установить точку эквивалентности. Если растворимость осадка значительна, то при титровании рекомендуется охладить анализируемый раствор или внести в систему, например, спирт для уменьшения диэлектрической проницаемости раствора.
1.3.2.3. Реакции комплексообразования
В кондуктометрическом методе используются различные комплексообразователи. Наиболее распространенным является двунатриевая соль этилендиаминтетрауксусной кислоты (ЭДТА) или трилон Б. При этом, вид кривой титрования будет определяться как природой определяемого иона, так и наличием буферной смеси в растворе. Отсюда возможны два вида кривых комплексонометрического титрования, которые рассмотрены ниже на отдельных примерах.
1. Титрование ионов металла раствором ЭДТА без применения буферного раствора.
Рассмотрим на примере кондуктометрического титрования водного раствора Fe3+. Реакция протекает по схеме: Fe3+ + H2Y2– = FeY– + 2H+. До точки эквивалентности ионы железа вытесняют в раствор ЭДТА высокоподвижные ионы водорода, в результате чего электропроводность возрастает. После точки эквивалентности при добавлении избытка титранта будет идти его протонирование:
H2Y2– + H+ = H3Y–,
 и накопившиеся в растворе при протекании первой реакции ионы водорода будут связываться в слабодиссоциируемую этилендиаминтетрауксусную кислоту. В результате этого процесса электропроводность раствора будет уменьшаться (рис. 1.7).
и накопившиеся в растворе при протекании первой реакции ионы водорода будут связываться в слабодиссоциируемую этилендиаминтетрауксусную кислоту. В результате этого процесса электропроводность раствора будет уменьшаться (рис. 1.7).
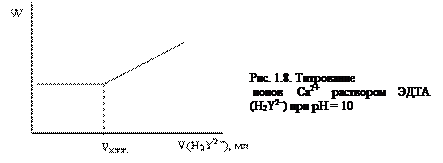
2. Титрование ионов металла раствором ЭДТА с применением буферного раствора.
Рассмотрим на примере кондуктометрического титрования водного раствора кальция. Анализ ведут в аммиачном буферном растворе при рН= 10. Реакция протекает по схеме: Ca2+ + H2Y2– = CaY2– + 2H+. До точки эквивалентности вытесняемые ионами Ca2+ ионы водорода связываются буферной смесью, поэтому электропроводность остается практически неизменной. После точки эквивалентности избыток титранта приводит к повышению электропроводности раствора (рис. 1.8).
 |
Дата публикования: 2015-09-17; Прочитано: 2289 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
