 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
От концентрации и температуры раствора
|
|
Электрическая проводимость растворов зависит от концентрации, температуры раствора, природы растворенного вещества, давления. Наиболее существенное влияние на электропроводность растворов из внешних факторов оказывают концентрация и температура.
1.2.2.1. Зависимость от концентрации
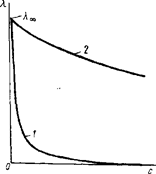
Удельная электропроводность раствора увеличивается с повышением концентрации раствора, т.е. с ростом числа ионов в единице объема. Однако с ростом концентрации растворенного вещества уменьшается степень диссоциации в случае слабых электролитов и растет взаимодействие между ионами в случае сильных электролитов, которое приводит к последующему снижению χ и зависимость χ от концентрации раствора проходит через максимум (рис. 1.1.a).
Эквивалентная электропроводность как сильных, так и слабых электролитов возрастает с увеличением разбавления и достигает некоторого предельного значения (рис. 1.1.б),так как возрастает площадь электродов и увеличивается объем раствора, содержащего моль-экв вещества.
 | |||
 | |||
| |||||
| |||||
| |||||
Рис. 1.1. Зависимость эквивалентной электрической проводимости растворов слабых (1) и сильных (2) электролитов (а) и удельной электропроводности (б) от их концентрации
Формально, сильные электролиты отличаются от слабых тем, что в разбавленных растворах они подчиняются уравнению Онзагера:
 , ,
| (1.8) |
где λ – эквивалентная электропроводность при данной концентрации; λ 0 – эквивалентная электропроводность при бесконечном разбавлении; μ – ионная сила раствора; B – постоянная величина, которая может быть рассчитана по уравнению:
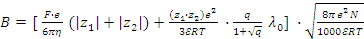 , (1.9) , (1.9)
|
где F – число Фарадея; e – элементарный заряд; z 1, z 2 – валентности ионов; η – вязкость растворителя; R – универсальная газовая постоянная; T – абсолютная температура; N – число Авогадро; 𝓔 – диэлектрическая проницаемость растворителя.
Кроме того, для сильных электролитов при малой концентрации раствора (< 10-3 М) широко используется эмпирическая формула Кольрауша:
 , (1.10)
, (1.10)
а в области более высоких концентраций лучшее совпадение с опытом дает уравнение Гхоша:
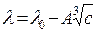 , (1.11)
, (1.11)
где А – константа, с – концентрация раствора.
Для разбавленных растворов слабых электролитов справедливо соотношение Аррениуса:

| (1.12) |
1.2.2.2. Влияние температуры
Зависимость эквивалентной проводимости от температуры определяется уравнением:
 , ,
| (1.13) |
где l01(25 0С), l01(t) – эквивалентная электрическая проводимость при 25 0С и температуре t соответственно, a - температурный коэффициент, зависящий от природы ионов и растворителя.
При увеличении температуры повышается степень диссоциации и уменьшается вязкость растворителя, что приводит к повышению λ0.
Величина температурного коэффициента при средних температурах в водных растворах для большинства ионов изменяется в пределах 0,02÷0,025, поэтому увеличение удельной и эквивалентной электропроводности раствора при повышении температуры на 1°C составляет примерно 2–2,5%.
Так как погрешность измерения электропроводности при изменении температуры высока, то при проведении кондуктометрических исследований растворы необходимо термостатировать.
Дата публикования: 2015-09-17; Прочитано: 2756 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
