 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Электрическая проводимость в растворах
|
|
Электропроводностью называется способность веществ (металлов, газов, жидкостей и др.) проводить электрический ток под воздействием внешнего источника электрического поля. Электропроводность измеряется в обратных омах (Ом–1) или сименсах (См): 1 См = 1 Ом-1.
Электропроводность раствора (W) представляет собой величину, обратную его электрическому сопротивлению (R):
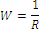
| (1.1) |
Сопротивление раствора прямо пропорционально расстоянию между электродами (l, м) и обратно пропорционально площади электродов (S, c м2), погруженных в раствор. Коэффициент пропорциональности (r) (Ом×м) называют удельным:

| (1.2) |
В случае l = 1 cм, S = 1 cм2, r =R, т. е. удельное сопротивление это сопротивление 1 cм3 раствора. Различают удельную (χ, Ом-1×м-1) и эквивалентную (λ, Ом×см2×г-экв-1) электропроводность. Удельная электропроводность – это электрическая проводимость объема раствора, заключенного между двумя параллельными электродами, имеющими площадь по 1 м2 и расположенными на расстоянии одного метра друг от друга. Представляет собой величину, обратную удельному сопротивлению:
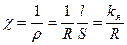
| (1.3) |
где kя – постоянная ячейки, определяемая с использованием стандартного раствора KCl, для которого значение χ известно. Например, при 25 0С удельная электропроводность 0,01 М водного раствора хлорида калия равна 0,1413 См/м.
Удельная электропроводность смеси соединений равна сумме проводимостей отдельных компонентов и растворителя:

| (1.4) |
При этом, χ чистой воды, рассчитанной теоретически, равна 5,5× 10 –6 См ´м –1
Эквивалентная электропроводность электролита (λ) представляет собой электропроводность раствора электролита, заключенного между двумя параллельными электродами, отстоящими друг от друга на расстоянии 1 м и имеющими такую площадь, что объем раствора, между электродами равен объему, содержащему 1 моль-экв растворенного вещества.
Удельная и эквивалентная электропроводности связаны между собой уравнением:
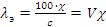 , ,
| (1.5) |
где с – концентрация электролита, моль/см3; V – разведение раствора, см3/г-экв.
Электропроводность раствора электролита складывается из электропроводности отдельных ионов. Свойства ионов характеризуются ионной эквивалентной электропроводностью или подвижностью (l+, l-) и определяются уравнениями:
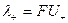 , , 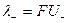
| (1.6) |
где F – постоянная Фарадея (96485 Кл/моль), U – электрическая подвижность иона, равная его скорости при напряженности электрического поля 1 В/м.
В бесконечно разбавленных растворах скорость движения ионов становится постоянной. Поэтому предельная эквивалентная электропроводность раствора электролита (l0) представляет собой постоянную величину, равную сумме эквивалентных электропроводностей катионов (l0+) и анионов (l0-) для предельно разбавленого раствора.

| (1.7) |
Для многозарядных ионов величину эквивалентной электропроводности относят к одному заряду.
Дата публикования: 2015-09-17; Прочитано: 441 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
