 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Процедура получения сыворотки крови
|
|
Кровь в количестве 5 мл, помещенную в стерильную, химически чистую, сухую пробирку, оставляют на 2 часа при комнатной температуре для свертывания. Затем стеклянной палочкой отделяют сгусток от стенок пробирки и помещают пробирку на 1 час в холодильник (+4°С), центрифугируют 10–15 мин при 1500 об/мин. Сыворотку отбирают в стерильную пробирку. При необходимости образец сыворотки крови сохраняют в течение 2–3-х месяцев в замороженном состоянии (-18 – -20 °С). Размораживать образец можно только однократно, поэтому сыворотку одного обследуемого индивида замораживают в несколько порций, используя пластиковые микропробирки на 1,5 мл или меньшего объёма. В сыворотке крови определяют концентрацию иммуноглобулинов и антигенспецифических антител, концентрацию и функциональную активность системы комплемента, концентрацию других иммуноактивных молекул.
Процедура определения количества клеток в исследуемом материале (процедура определения концентрации лейкоцитов в периферической крови) необходима при проведении любой реакции и любого метода с использованием клеток, подвергаемых изучению. Так как образцы клеток ограничены по численности клеток и объёму имеющегося материала, то применяется рутинный подсчёт количества клеток в счётной камере Горяева.
Принцип процедуры заключается в разведении клеточной суспензии значительным объёмом солевого буферного раствора, что снижает концентрацию клеток в суспензии, упрощая их микроскопическую визуализацию при достаточном уровне точности. При определении количества лейкоцитов в крови вместо солевого буферного раствора используют 3–5%-ную уксусную кислоту с добавлением метиленового синего для лизиса эритроцитов, мешающих визуализации лейкоцитов и контрастирования лейкоцитов в поле зрения.
Камера Горяева представляет собой специальное стекло (рис. 1.7), в углублении которого (0,1 мм) нанесена сетка с большими и малыми квадратами строго определенного размера (рис. 1.8).
 |
Рисунок 1.7 Камера Горяева для подсчёта клеток: слева – общий вид, справа – устройство камеры и камера в собранном виде
 Сетка камеры Горяева изготавливается специальным путём и представляет собой ряд перекрещивающихся линий, образующих большие и малые квадраты (рис. 1.8). Большие квадраты используют для определения количества лейкоцитов, лимфоцитов, а малые – для определения количества эритроцитов, тромбоцитов. Всего в камере Горяева 100 больших квадратов, которые собраны по 4 в группы, располагающиеся по 5 штук по вертикали и горизонтали.
Сетка камеры Горяева изготавливается специальным путём и представляет собой ряд перекрещивающихся линий, образующих большие и малые квадраты (рис. 1.8). Большие квадраты используют для определения количества лейкоцитов, лимфоцитов, а малые – для определения количества эритроцитов, тромбоцитов. Всего в камере Горяева 100 больших квадратов, которые собраны по 4 в группы, располагающиеся по 5 штук по вертикали и горизонтали.
Рисунок 1.8 Сетка камеры Горяева
Перед работой камеру Горяева тщательно протирают сухой салфеткой и притирают к ее поверхности покровное стекло таким образом, чтобы по его краям появились радужные полосы.
Порядок подготовки образца крови для определения их числа (на примере подсчёта лейкоцитов цельной крови): в химическую пробирку вносят 0,4 мл 3% уксусной кислоты. Затем в этот объём уксусной кислоты вносят 0,02 мл (20 мкл) периферической крови. Перемешивают, наблюдая за просветлением раствора за счёт разрушения эритроцитов. После этого переходят к заполнению камеры Горяева суспензией лейкоцитов в уксусной кислоте.
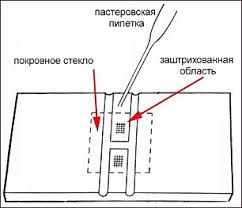 Для этого к краю покровного стекла подносят каплю суспензии лейкоцитов пастеровской пипеткой или дозатором (рис. 1.9). Благодаря силам поверхностного натяжения суспензия втягивается в нужном количестве в пространство между камерой Горяева и покровным стеклом. Излишки убирают фильтровальной бумагой.
Для этого к краю покровного стекла подносят каплю суспензии лейкоцитов пастеровской пипеткой или дозатором (рис. 1.9). Благодаря силам поверхностного натяжения суспензия втягивается в нужном количестве в пространство между камерой Горяева и покровным стеклом. Излишки убирают фильтровальной бумагой.
Рисунок 1.9 Внесение суспензии
Клеток в камеру Горяева
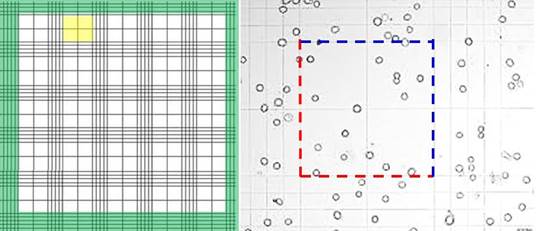 |
Камеру оставляют на горизонтальной поверхности около 1 минуты для оседания клеток крови и затем микроскопируют на малом увеличении светового микроскопа при опущенном конденсоре и прикрытой диафрагме для лучшего контрастирования клеток. Определение количества лейкоцитов проводят в 100 больших квадратах, переводя поле зрения микроскопа последовательно по всем группам больших квадратов (рис. 1.10). Часто клетки располагаются по границе больших квадратов. В этом случае принимают причисление клеток только по нижней и левой границам или только по верхней и правой границам.
Рисунок 1.10 Слева: общий вид сетки камеры Горяева на малом увеличении (зелёным показано всё рабочее поле, подлежащее исследованию, жёлтым цветов выделена группа из 4 больших квадратов, в которых и сосчитывают лейкоциты). Справа: лейкоциты в больших квадратах (большое увеличение), показана методика включения лейкоцитов, располагающихся по границе больших квадратов – к сосчитываемым причисляют те клетки, которые располагаются только по нижней и левой границе (красный пунктир) или по верхней и правой границе (синий пунктир)
Обычно определение количества клеток в камере Горяева проводят с использованием клавишного механического счётчика клеток (рис. 1.11, существуют их разные модели). Увиденную клетку регистрируют, делая нажатие на клавишу, при этом прибор фиксирует это нажатие прибавлением 1. В конце исследования всех 100 квадратов достаточно прочесть образованное число на панели счётчика.

 Рисунок 1.11 Некоторые модели механического счётчика клеток крови
Рисунок 1.11 Некоторые модели механического счётчика клеток крови
Расчет количества лейкоцитов в 1 мкл крови проводят, исходя из разведения крови (20), числа сосчитанных квадратов (100) и объема 1 большого квадрата (1/250 мкл), по следующей формуле:
X= (a´ 250 ´ 20) / 100 = a´ 50, где а – количество сосчитанных лейкоцитов. Для определения количества лейкоцитов в 1 мл или в 1 л крови полученный показатель соответственно умножают на 103 или 106.
Процедура морфологической идентификации клеток крови в микроскопическом препарате, окрашенном стандартным методом, применяется для оценки степени гомогенности популяционного состава приготавливаемой суспензии клеток. Например, фагоцитоз удобнее изучать на суспензии изолированных нейтрофилов. Промежуточное исследование подготавливаемой суспензии помогает понять качество последующего результата.
В рамках обычного анализа крови эту процедуру используют для определения так называемой лейкоцитарной формулы, то есть выраженного в процентах по каждой популяции лейкоцитов состава.
Для приготовления микроскопического препарата каплю крови наносят на край предметного стекла (сухого и тщательно обезжиренного), плотно прикасаются к ней краем шлифованного стекла – кровь распределяется по его длине. Быстрым движением растягивают кровь по всей поверхности предметного стекла – микроскопический препарат крови готов после высыхания к дальнейшей обработке.
Приготовленный мазок крови высушивают на воздухе и фиксируют, помещая предметное стекло в ёмкость с фиксатором. Фиксация осуществляется спиртами или иными специальными составами, от которых зависит время фиксации. При использовании метанола достаточно 5 минут инкубации, при использовании этанола или смеси Никифорова (этанол:эфир = 1:1) – 15 минут.
Затем мазок помещают в кювету с красителем либо наливают краситель на препарат. В основном для окрашивания мазков крови используют краситель Романовского-Гимзы, азур II-эозин, краситель Май-Грюнвальд. Время окрашивания определяют для каждой серии красителя опытным путем, обычно оно составляет 20–30 минут. После окрашивания мазок промывают водой, просушивают фильтровальной бумагой и микроскопируют на масляной иммерсии на большом увеличении светового микроскопа.
Микроскопию начинают, отступя 3–5 полей зрения от края мазка и передвигаясь по нему в перпендикулярных направлениях, проходя по 3–5 полей зрения. Для регистрации результатов используют 11-клавишный счетчик клеток (рис. 1.11). Всего подсчитывают не менее 100 лейкоцитов, определяя по счетчику процентное содержание каждой популяции.
При идентификации клеток крови использую морфологические признаки клеток (табл. 1.1).
Таблица 1.1.
Морфологическая характеристика лейкоцитов периферической крови человека
Дата публикования: 2015-09-18; Прочитано: 4124 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
