 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Приклади розв’язку завдань. Приклад 1. Який склад ядер ізотопів і , і
|
|
Приклад 1. Який склад ядер ізотопів 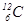 і
і 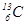 ,
, 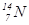 і
і 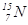 ?
?
Відповідь: Число протонів в ядрі дорівнює порядковому номеру елемента, яке однакове для всіх ізотопів даного елемента. Порядковий номер елемента записують зліва внизу перед символом елемента, а зліва зверху – масове число. Число нейтронів (n) дорівнює різниці масового числа і числа протонів (p).
Склад вказаних ядер наступний:
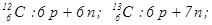
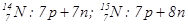
Приклад 2. Складіть повну та скорочену електронну формули елемента з порядковим номером 20.
Відповідь: За порядковим номером визначаємо, що це –Кальцій.
Його повну електронну формулу записують таким чином:

Скорочена електронна формула 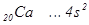 .
.
Приклад 3. Атом елемента має на 7 електронів більше, ніж йон натрію. Назвіть елемент, складіть електронну формулу його атома та напишіть розподіл електронів у енергетичних комірках у незбудженому та збудженому станах. Вкажіть число валентних електронів у цих станах.
Відповідь: Атом натрію має електронну формулу:
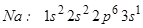 (11 електронів)
(11 електронів)
Йон натрію 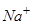 матиме завершену електронну оболонку:
матиме завершену електронну оболонку:
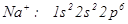 (10 електронів)
(10 електронів)
Наступні сім електронів розташовані відповідно на 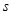 і
і 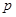 підрівнях третього рівня. Сумарна кількість електронів буде:
підрівнях третього рівня. Сумарна кількість електронів буде: 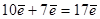 .
.
Електронна формула елемента:
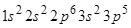
Цей елемент – Хлор. Він має незаповнений 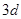 -підрівень. На цей підрівень і переходять електрони з
-підрівень. На цей підрівень і переходять електрони з 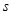 - і
- і 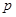 - підрівня третього рівня в збудженому стані.
- підрівня третього рівня в збудженому стані.
Валентні електрони – це неспарені електрони, які знаходяться на зовнішніх атомних орбіталях в окремих комірках.
Розподіл електронів по комірках у незбудженому стані для  такий:
такий:
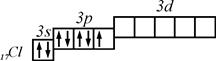
В незбудженому стані атом  має один валентний електрон.
має один валентний електрон.
В збудженому стані на 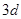 -підрівень може переходити відповідно один, два і три електрони. Тому для збудженого стану характерні три можливі комбінації відповідно з трьома, п’яти та семи неспареними електронами:
-підрівень може переходити відповідно один, два і три електрони. Тому для збудженого стану характерні три можливі комбінації відповідно з трьома, п’яти та семи неспареними електронами:

В збуджених: а) 3 валентні електрони, б) 5 валентних електронів, в) 7 валентних електронів.
КОНТРОЛЬНІ питання
1. Сучасне формулювання періодичного закону.
2. Структура періодичної системи хімічних елементів Д.І. Менделєєва.
3. У чому полягає ефект f- стиснення?
4. Дайте визначення термінам «енергія йонізації», «енергія спорідненості до електрона», «електронегативність».
5. Закономірності зміни властивостей елементів у періодах і підгрупах.
6. Яка структура періодичної системи? Скільки у ній періодів та груп і як вони поділяються?
7. Які елементи четвертого періоду періодичної системи є найтиповішими металом і неметалом? Чому?
8. Хлор і манган знаходяться в одній групі періодичної системи. Чим пояснюється відмінність в їх хімічних властивостях? Відповідь обґрунтуйте.
9. Конфігурація зовнішніх електронних оболонок атомів 5s2 і 4s2 4p5. В яких групах і періодах знаходяться ці елементи?
Дата публикования: 2015-09-18; Прочитано: 750 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
