 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Распространение, химическая природа и механизм действия
|
|
Каталаза широко распространена в растительных тканях. Она найдена почти во всех аэробнодышащих клетках и у некоторых факультативных анаэробов. Каталаза относится к Fe-порфириновым ферментам. Железо, входящее в состав простетической группы каталазы, по имеющимся данным, не изменяет своей валентности в процессе катализа. Фактически во всех изолированных ферментах, содержащих железо, металл включен в порфирины в форме клешневидных хелатоподобных комплексов, но не присоединен непосредственно к белку.
Молекулярный вес кристаллической каталазы, активность ее и некоторые другие свойства, хотя и незначительно, но все же варьируют в зависимости от источника получения фермента, В связи с этим можно говорить о различных каталазах, подобно тому, как говорят о различных пероксидазах. Эти различия обусловлены, главным образом, различием в составе или структуре белкового компонента. Однако возможно, что у разных каталаз содержится неодинаковое число гематиновых групп. Например, каталаза растительного происхождения содержит только одну группу протогематина, тогда как катализа животного происхождения — четыре. Это подтверждается данными по определению интенсивности спектров, обусловленных протогематином, а также по содержанию железа. О различии свойств растительной и животной каталаз можно было бы достоверно судить только при сравнении кристаллических препаратов ферментов, свободных от примесей. Однако свободные от примеси кристаллические препараты каталазы пока не получены.
Сущность каталитического действия каталазы состоит в разложении перекиси водорода с выделением молекулярного кислорода. Реакция с участием каталазы требует двух молекул перекиси из которых одна действует как донатор, а другая как акцептор электронов.
Результаты многочисленных работ Б. Чанса, X. Теореля и Д. Кейлина позволяют представить механизм каталазной реакции следующим образом:
2Н2О2 → 2Н2О + О2
1. Fe ОН + НООН → Fe ООН + Н2О
2. Fe ООН + НООН → Fe ОН + Н20 + 02
В реакции 1 происходит взаимодействие гидроксила гематина с перекисью водорода, в результате чего образуется солеобразное соединение 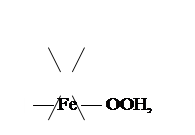 представляющее собой одно из промежуточных соединений, — нестойкий перекисный комплекс I. Такой же комплекс образуется при действии пероксидазы на перекись водорода, или на органическую перекись. Разница состоит в том, что комплекс I пероксидаза — ООН быстро переходит в комплекс II в присутствии донаторов водорода (например, полифенолов). При действии же каталазы комплекс I с перекисью водорода по мере образования восстанавливается другой молекулой перекиси, как это видно из реакции 2.
представляющее собой одно из промежуточных соединений, — нестойкий перекисный комплекс I. Такой же комплекс образуется при действии пероксидазы на перекись водорода, или на органическую перекись. Разница состоит в том, что комплекс I пероксидаза — ООН быстро переходит в комплекс II в присутствии донаторов водорода (например, полифенолов). При действии же каталазы комплекс I с перекисью водорода по мере образования восстанавливается другой молекулой перекиси, как это видно из реакции 2.
Образование комплекса II в каталазной реакции представляет собой лишь побочную реакцию. Она ведет к инактивации каталазы и протекает медленнее по сравнению с реакцией каталитического разложения перекиси. Кроме перекиси водорода, каталаза разлагает также некоторые однозамещенные производные этой перекиси (например, моноэтилгидропероксид). На двузамещенные производные каталаза, в отличие от пероксидазы, не действует.
Изложенная теория действия каталазы хорошо объясняет неизменяемость валентности железа при действии этого фермента, а также ингибирование каталазы кислотами.
Кроме соединений (цианиды, азиды, сульфиды, гидроксиламин), которые блокируют железо гематиновой группы и таким путем инактивируют все гемпротеиновые ферменты, каталаза угнетается соединениями, которые не являются специфическими ферментными ядами. К таким соединениям относятся нитраты, ионы хлора, ацетата, фосфата, сульфата и др.
Торможение активности каталазы нитратным ионом среди других анионов оказывается наиболее сильным. Химически угнетающее действие анионов можно представить следующим образом. Гидроксильный ион, непосредственно участвующий в реакции каталазы с перекисью, может при определенных условиях быть вытесненным другим анионом, который займет место у железа. Таково химическое объяснение действия нитратов и других солей на каталазу; аналогично действуют они и на пероксидазу.
|
 Механизм тормозящего влияния, оказываемого на каталазу многими кислотами (в частности, муравьиной, которая в концентрации 0,02 М почти полностью инактивирует каталазу) можно себе представить следующим образом:
Механизм тормозящего влияния, оказываемого на каталазу многими кислотами (в частности, муравьиной, которая в концентрации 0,02 М почти полностью инактивирует каталазу) можно себе представить следующим образом:
 |  |
где R — является какой-либо кислотой.
Из уравнения видно, что и в этом случае происходит удаление гидроксила, являющегося активным центром каталазы.
Дата публикования: 2015-07-22; Прочитано: 2025 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
