 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Алюминиді электролиттік әдіспен алудың теориялық негіздері
|
|
Әлемнің барлық алюминий өндіретін елдерінде алюминийді ерітілген алюминий тотығын (Al2O3) балқытылған криолитте (Na3AlF6 немесе 3NaF·AlF3) электролиздеу арқылы алады.
Электорлиздеу кезінде алюминий тотығы таза алюминий өндірісінің негізгі шикізаты бола отырып, үздіксіз шығынданып, төмендегі реакция үлгісі бойынша ыдырап, таза алюминий катодта, ал оттегі анодта бөлініп отырады
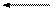
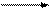 Al2O3 2Al +1,5O2 – Q (4.1)
Al2O3 2Al +1,5O2 – Q (4.1)
Егер электролиз процессін инертті түрде жүргізсе, мысалы платиналық анодпен, онда оттегі анодпен химиялық әректтесуге түспей, оның беткі жағынан өз бетімен босайды.
Өндірісте алюминиді электролиттік жолмен алғанда көмірлі анодтарды қолданады, олар бөлінген оттегімен өзара әрекеттесіп, СО2 немесе СО газдарын түзеді.
Осыған байланысты алюминий тотығының ыдырауы шамамен мынадай теңдеулер арқылы жазылады


 2Al2O3 +3C 4Al +3CO2 +Q1 (4.2)
2Al2O3 +3C 4Al +3CO2 +Q1 (4.2)
 2Al2O3 +3C 2Al +3CO + Q2 (4.3)
2Al2O3 +3C 2Al +3CO + Q2 (4.3)
Электролиз процесі кезінде балқыған криолит оң зарядталған 3Na+ мен теріс оқтамдалған AlF6 3- иондарына диссоциалынады.
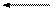
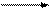 Na3AlF6 3 Na+ + AlF6 3- (4.4)
Na3AlF6 3 Na+ + AlF6 3- (4.4)
Алюминий тотығы Al3+ және О2- иондарына, ал AlF3 - Al3+ және F- иондарына ыдырайды.
Al3+, Na+, F- және О2- иондары балқымада өзара әрекеттесіп, AlF6-, AlO2, , AlO+ сияқты комплексті иондар құрайды.
Барлық иондар тоқты тасмалдауға қатысады, бірақ мімкіндік қуаттарының дәрежесінің көрсеткіштеріне сәйкес электродтарда Al3+ және О2- иондары оқтамдалынады.
Катодта: 2Al3+ + 6е 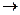 2Al, (4.5)
2Al, (4.5)
Анодта: 3О2– – 6е +1,5С 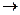 1,5СО2 (4.6)
1,5СО2 (4.6)
Сонымен электролиз процесі үздіксіз алюминий тотығының шығындалуының нәтижесінде таза алюминиді өндіру болып табылады.
Дата публикования: 2015-07-22; Прочитано: 691 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
