 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
в равновесных химических реакциях
|
|
Цель работы: овладение методикой расчета констант равновесия при заданной температуре и теоретического выхода продуктов реакции на примере реакций, протекающих в газовой фазе.
Теоретические сведения
Знание величин изменения термодинамических потенциалов и констант равновесия до конца не решает инженерно-технологической задачи, так как для каждой конкретной реакции необходимо еще определить теоретический (максимально возможный) выход продуктов реакции. Под выходом продуктов реакции понимают равновесные концентрации образующихся в результате реакции веществ. Выход продуктов реакции определяют, решая уравнение закона действия масс относительно равновесной концентрации одного из продуктов реакции.
Чаще всего функциональная зависимость константы химического равновесия от равновесной концентрации продукта реакции выражается уравнением второго, третьего и более высоких порядков, которые решаются с помощью численных методов.
Порядок выполнения работы
1. Для реакции (табл. 3.3), протекающей в газовой фазе при стандартных условиях рассчитать:
– изобарно-изотермический потенциал реакции Δ rG 0 при температуре Т (табл. 3.3) по методу Темкина-Шварцмана (1.23); методика расчета приведена в работе № 5;
– величину константы равновесия К р при той же температуре по уравнению
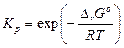 .
.
2. Для заданной реакции рассчитать выход целевого продукта в предположении стехиометрического состава системы в исходном состоянии и давлении р = 2·105 Па.
Ниже приводится методика расчета, рассмотренная на конкретном примере.
Пример. Для реакции 2 А = В + 2 С, протекающей в газовой фазе при Т = 1000 К и р = 105 Па, определить выход продуктов В и С при условии, что константа равновесия известна и равна
Кр = 1,65×105. Продукты считать идеальными газами.
Расчет.
1. Определить количества веществ А, В, и С до реакции и при равновесии, используя стехиометрические коэффициенты. Количество вещества А до реакции принять равным его стехиометрическому количеству, т. е. 2 моль, количество веществ В и С – нулю. По истечении определенного промежутка времени от начала реакции в системе (реакционной смеси) устанавливается равновесие, при этом продукты реакции В и С образовались за счет убыли исходного вещества А.
К моменту равновесия образовалось n моль вещества В, тогда в соответствии со стехиометрией реакции к моменту равновесия образовалось 2 n моль вещества С и при этом израсходовалось 2 n моль вещества А. Таким образом, реакционная смесь в момент равновесия будет содержать (2 – 2 n) моль вещества А, 2 n моль вещества С и n моль вещества В. Сокращенно можно записать:
2А = В + 2С
исходное кол-во веществ: 2 0 0
кол-во веществ в равновесии: (2 – 2 n) n 2 n.
2. Определить общее число моль равновесной газовой смеси
Σ ni = (2 – 2 n) + n + 2 n = 2 + n.
3. Определить мольную долю каждого компонента по соотношению
xi = ni /Σ ni.
Мольные доли веществ А, В и С равны соответственно:
xА = (2 – 2 n)/(2 + n);
xВ = n /(2 + n);
xС = 2 n /(2 + n).
4. Выразить константу равновесия Кх, через мольные доли xА, xВ, xС веществ А, В и С соответственно
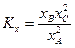 ,
,

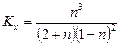
5. Выразить константу равновесия Кp через парциальные давления компонентов рi. По закону Дальтона парциальное давление компонента в идеальной газовой смеси выражается уравнением
рi = xip,
где р – общее давление газовой смеси, Па. Константы химического равновесия Кх и Кр связаны между собой соотношением (3.11).
В рассматриваемом примере Δ n = 1 + 2 – 2=1, а Кр = Кхр.
Тогда, выражение для константы равновесия запишется
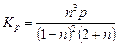 . (3.16)
. (3.16)
Решив уравнение (3.16) относительно n при известных Кр и р любым известным методом (например, методом простой итерации или методом Ньютона), достигают поставленной задачи.
Если ставится задача определения выхода продуктов реакции по известной концентрационной константе Кс, необходимо иметь данные о температуре протекания реакции и воспользоваться формулой (3.11).
Таблица 3.3
| Х | Реакция | Целевой продукт | У | Температура (Т), К |
| 2С2Н5ОН = СН3СОСН3 + 3Н2 +СО | СН3СОСН3 | |||
| СО2 + Н2 = НСООН | НСООН | |||
| СО + Н2О = НСООН | НСООН | |||
| СО2 + 3Н2 = СН3ОН +Н20 | СН3ОН | |||
| С2Н6 +СО = СН3СОСН3 | СН3СОСН3 | |||
| С2Н4 + Н2О = С2Н5ОН | С2Н5ОН | |||
| С2Н6 = С2Н4 + Н2 | С2Н4 | |||
| СО2 + 4Н2 = СН4 + 2Н2О | СН4 | |||
| СН4 + СО2 = 2СО + 2Н2 | СО | |||
| СО + 2Н2 = СН3ОН | СН3ОН |
Контрольные вопросы и задания
1. Что такое выход продукта реакции, от чего он зависит?
2. Как можно увеличить выход целевого продукта?
3. Выразите константу равновесия химической реакции, через: активности, парциальные давления, концентрации, мольные доли участников реакции и приведите связь между константами.
4. Приведите методику расчета констант равновесия химических реакций по методу Шварцмана-Темкина.
5. Приведите методику расчета теоретического выхода продуктов реакции.
Дата публикования: 2015-07-22; Прочитано: 615 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
