 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Изотерма химической реакции
|
|
Глава 3. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Решение вопроса о способности веществ вступать в химическую реакцию является одним из важнейших для физической химии. Это позволяет предсказывать ход химического процесса, конечный результат и дает возможность управлять химическим процессом.
Изотерма химической реакции
Оценить возможность самопроизвольного протекания реакции и удаленность системы от состояния равновесия можно, исходя из общих термодинамических представлений. Для этого необходимо использовать изменение изохорно-изотермического D FV,T или изобарно-изотермического D Gp,T потенциалов для превращения некоторого количества веществ в реакционной смеси данного состава при постоянных V, T или p, T соответственно.
Рассмотрим гомогенную реакцию, протекающую при постоянном давлении р и температуре T, вида
a A + bB ® dD + lL.
Предположим, что участвующие в ней вещества A, B, D и L находятся в таких количествах, что убыль а моль компонента А,
b моль компонента В и образование продуктов не приводит к изменению состава и условий существования системы.
Изменение энергии Гиббса D rGp,T в реакции равно разности сумм энергий Гиббса продуктов реакции и исходных веществ:
D rGp,T = l Δ  + d Δ
+ d Δ  – (a Δ
– (a Δ  + b Δ
+ b Δ 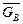 ),
),
где Δ  – мольные энергии Гиббса (химические потенциалы) соответствующих компонентов A, B, D и L.
– мольные энергии Гиббса (химические потенциалы) соответствующих компонентов A, B, D и L.
При подстановке выражения для химического потенциала компонента раствора (2.8) в последнее уравнение получают
 , (3.1)
, (3.1)
где a – текущие (начальные) термодинамические активности участников реакции, возведенные в степени, соответствующие эквивалентам участников реакции (стехиометрическим коэффициентам реакции);  – стандартный изобарно-изотермический потенциал реакции, зависящий от природы участников реакции и температуры;
– стандартный изобарно-изотермический потенциал реакции, зависящий от природы участников реакции и температуры;
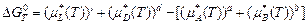 .
.
Уравнение (3.1) называется уравнением изотермы химической реакции, или изотермой Вант-Гоффа.
При постоянных давлении и температуре общим условием термодинамического равновесия является D rGp,T = 0. Тогда активности всех компонентов являются равновесными, и из изотермы Вант-Гоффа (3.1) следует, что
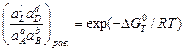 .
.
Так как правая часть зависит только от температуры и природы участников химической реакции, следовательно, и левая часть является константой при постоянной температуре. Она называется термодинамической константой равновесия химической реакции:
Kа =  . (3.2)
. (3.2)
Для любой химической реакции отношение произведения равновесных активностей продуктов реакции к произведению равновесных активностей исходных веществ, возведенных в степени, равные их стехиометрическим коэффициентам, является величиной постоянной, зависящей только от температуры. Термодинамическая константа равновесия является безразмерной величиной.
Уравнение, связывающее стандартное изменение энергии Гиббса химической реакции с константой равновесия, имеет вид
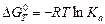 . (3.3)
. (3.3)
Таким образом, изотерма Вант-Гоффа, связывающая стандартные термодинамические характеристики и исходные количества реагирующих веществ, по которой можно вычислять изменение термодинамического потенциала химической реакции, имеет вид
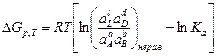 , (3.4)
, (3.4)
где Ka соответствует (3.2).
Для оценки возможности протекания химической реакции используется величина химического сродства, то естьмера способности веществ взаимодействовать друг с другом.
Мерой химического сродства является максимальная полезная работа, то есть работа обратимого химического процесса. Согласно теории термодинамических потенциалов
в изохорно-изотермических процессах
(Аmax)V,T = – Δ FV,T;
в изобарно-изотермических процессах
(Аmax)p,T = – Δ Gp,T.
В этих условиях полезная работа становится функцией состояния, то есть не зависит от пути протекания процесса; максимальная полезная работа определяется убылью термодинамических потенциалов; химическое сродство связано с константой термодинамического равновесия.
Выражение (3.4) используется для оценки величины химического сродства реакции в изобарно-изотермических условиях. Если известна константа равновесия химической реакции, легко оценить знак выражения, стоящего в квадратных скобках данного уравнения:
– если первый член этого выражения меньше второго, реакция будет идти самопроизвольно слева направо, так как для этого процесса D Gp,T < 0;
– если первый член выражения больше второго, то D Gp,T > 0 и самопроизвольно будет протекать обратная реакция;
– если же окажется, что сумма, стоящая в квадратных скобках, равна нулю, то реакция находится в состоянии термодинамического равновесия (D Gp,T = 0).
Величина химического сродства зависит от природы химической системы, константы равновесия, температуры и текущих активностей.
Для того чтобы иметь возможность сравнивать сродство в различных реакциях, используется величина стандартного химического сродства. Стандартным химическим сродством считается химическое сродство при текущих активностях всех участников реакции, равных 1.
Величина стандартного химического сродства может быть рассчитана по выражению (3.3) и использована для сравнения реакционной способности различных веществ. Из уравнения (3.3) следует, что, если 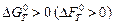 , то есть Ка < 1, это значит, что данная реакция не идет самопроизвольно в стандартных условиях. Если
, то есть Ка < 1, это значит, что данная реакция не идет самопроизвольно в стандартных условиях. Если  при данной температуре имеет отрицательное значение, то есть Ка >1, то реакция осуществима в стандартных условиях.
при данной температуре имеет отрицательное значение, то есть Ка >1, то реакция осуществима в стандартных условиях.
Если химическая реакция проводится в таких условиях, что систему можно считать идеальным раствором, например, в разбавленных растворах, то выражение для химического потенциала компонента системы можно записать так:
μi =  (T) + RT ln ci,
(T) + RT ln ci,
где сi – молярная концентрация i -го компонента раствора.
Тогда для реакции, протекающей в растворе, уравнение изотермы химической реакции, выраженной через молярные концентрации компонентов, имеет вид:
 .
.
В равновесии D FV,T = 0 и тогда:
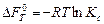 ,
,
где Kc – константа равновесия химической реакции, выраженная через молярные концентрации компонентов, [c] = моль/м3;
|
 (3.5)
(3.5)
С учетом (3.5) изотерма химической реакции примет вид
 . (3.6)
. (3.6)
Если химическая реакция протекает в идеальной газовой системе и выражение для химического потенциала (2.5), то уравнение изотермы химической реакции примет вид
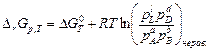 . (3.7)
. (3.7)
В равновесии D Gp,T = 0 и тогда
 , (3.8)
, (3.8)
где Kp – константа равновесия химической реакции, выраженная через парциальные давления компонентов, [p] = Па;
 . (3.9)
. (3.9)
Уравнение (3.7) с учетом (3.8)-(3.9) преобразуется:
 . (3.10)
. (3.10)
Поскольку –D Gp,T = (А¢max) p,T и –D FV,T = (А¢max) V,T , уравнения изотерм химической реакции (3.6), (3.10) позволяют из результатов изучения химического равновесия рассчитать максимальную полезную работу, которую можно получить при различных составах реакционной смеси и определить химическое сродство реакций.
Кроме того, константу равновесия химической реакции можно выразить через равновесные мольные доли хi участников реакции. Поскольку рi = xip, для рассматриваемой реакции можно записать
Kх =  .
.
Последняя константа химического равновесия в отличие
от Kр и Kc зависит от общего давления в реакционной системе.
Константы Kp, Kc и Kх связаны друг с другом соотношением
Kр = Kc (RT) Δ n = Kх р Δ n, (3.11)
где Δ n = (l + d) – (a + b)– разница между количеством моль газообразных продуктов реакции и исходных веществ; Т – температура, К; р – давление в реакционной смеси, Па.
Дата публикования: 2015-07-22; Прочитано: 2427 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
