 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Реакции этерификации
|
|
Цель работы: овладение методикой изучения равновесия в гомогенных реакциях, и определение концентрационной
константы равновесия реакции этерификации.
Реактивы: кислота уксусная концентрацией 4 моль/дм3, кислота уксусная концентрацией 2 моль/дм3, кислота соляная концентрацией 0,5 моль/дм3, спирт этиловый, этиловый эфир уксусной кислоты, вода дистиллированная, натрия гидроксид концентрацией 0,5 моль/дм3, натрия гидроксид концентрацией
0,1 моль/дм3, натрия гидроксид концентрацией 0,05 моль/дм3, спиртовой раствор фенолфталеина.
Теоретические сведения
Методы определения констант равновесия условно можно разделить на две группы: прямые (аналитические) и косвенные (термодинамические).
Аналитические методы экспериментального изучения химического равновесия сводятся к определению равновесного состава смеси, состоящей из исходных веществ и продуктов реакции, при постоянных внешних условиях. Если известны начальные концентрации реагирующих веществ, то после достижения равновесия достаточно определить равновесную концентрацию одного участника реакции. Остальные рассчитываются с помощью уравнения химической реакции.
Необходимо учитывать, что химические методы определения состава реакционной смеси можно применять лишь в тех случаях, когда отбор проб не приводит к сдвигу равновесия, поэтому удобнее всего использовать физические методы анализа, не изменяющие состояния равновесия.
В основе косвенных методов лежат уравнения:
 ,
,
 ,
,
позволяющие по экспериментально установленному значению максимальной полезной работы ( или
или 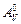 ) или рассчитанным изменениям термодинамических потенциалов (
) или рассчитанным изменениям термодинамических потенциалов ( или
или 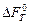 ) в изохорных или изобарных условиях определить константу равновесия. Данные методы могут быть применены для оценки константы равновесия в любой химической системе, но по точности определения они уступают прямым методам.
) в изохорных или изобарных условиях определить константу равновесия. Данные методы могут быть применены для оценки константы равновесия в любой химической системе, но по точности определения они уступают прямым методам.
В работе изучается равновесие реакции этерификации:
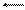
 СН3СООН + С2Н5ОН СН3СООС2Н5 + Н2О
СН3СООН + С2Н5ОН СН3СООС2Н5 + Н2О
Изменение энтальпии данной реакции при температуре
298 К, согласно следствию из закона Гесса (см. гл. 1), равно:
 кДж/моль.
кДж/моль.
Теплота образования этилацетата мала, поэтому константа равновесия этой реакции, как следует из уравнения
 ,
,
практически не зависит от температуры. Поэтому для ускорения достижения равновесия реакцию проводят при температуре
70 – 80 оС и в присутствии соляной кислоты в качестве катализатора.
Изучается равновесие в условиях достижении его как в ходе прямой, так и в ходе обратной реакции.
За изменением состава реакционной смеси следят по изменению суммарной концентрации кислоты.
Порядок выполнения работы
1. Приготовить 4 сухие конические колбы вместимостью
50 cм3 и пронумеровать их.
В первую колбу налить 15 см3 раствора уксусной кислоты с концентрацией 4 моль/дм3, 5 см3 раствора соляной кислоты с концентрацией 0,5 моль/дм3 и 5 см3 этилового спирта.
Во вторую колбу налить 15 см3 раствора уксусной кислоты с концентрацией 2 моль/дм3, 5 см3 раствора соляной кислоты с концентрацией 0,5 моль/дм3и 5 см3 этилового спирта.
В третью колбу налить 15 см3 дистиллированной воды,
5 см3 этилового эфира уксусной кислоты и 5 см3 раствора соляной кислоты с концентрацией 0,5 моль/дм3.
В четвертую колбу налить 12 см3 дистиллированной воды,
3 см3 этилового эфира уксусной кислоты и 5 см3 раствора соляной кислоты с концентрацией 0,5 моль/дм3.
2. Каждую колбу соединить с холодильником, поместить в водяной термостат, установленный на температуру 70-80 °С (время погружения каждой колбы в термостат отметить отдельно). Провести нагревание каждой колбы в течение 2 ч.
3. Определить концентрацию соляной и уксусной кислот, использованных для составления реакционных смесей. Для этого в две колбы налить приблизительно по 50 см3 дистиллированной воды, прилить в одну из них 1 см3 уксусной кислоты, а во вторую – 5 см3 соляной кислоты и оттитровать их раствором гидроксида натрия концентрацией 0,5 моль/дм3 в присутствии раствора фенолфталеина.
4. Через 2 ч отобрать пробы последовательно из каждой реакционной колбы. Для этого колбу вынуть из термостата, не отсоединяя от холодильника, и поместить в охладительную смесь (воду со льдом и солью) во избежание изменения состава смеси за счет испарения. Приготовить колбу для титрования, налив в неё приблизительно 50 см3 дистиллированной воды. После охлаждения отобрать пипеткой и перенести в колбу для титрования
1 см3 пробы. Затем вновь присоединить к реакционной колбе холодильник и поместить ее в термостат. В отобранной пробе определить суммарную концентрацию кислот титрованием раствором гидроксида натрия с концентрацией 0,1 моль/дм3 в присутствии фенолфталеина.
Концентрацию кислоты в реакционной смеси определять через каждые 30 мин до установления равновесия реакции. Равновесие считается достигнутым, когда результаты титрования двух проб совпадут на уровне ошибки определения. Опыт с данной смесью можно считать законченным.
Обработка опытных данных
Условные обозначения в формулах для расчета:
Vсп, Vук, Vэт, Vв, Vск – объемы соответственно этилового спирта, уксусной кислоты, этилового эфира уксусной кислоты, воды и соляной кислоты, взятые для составления смеси, дм3;
rсп, rук, rэт, rск – плотности соответственно этилового спирта, уксусной кислоты, этилового эфира уксусной кислоты и соляной кислоты, кг/м3;
ссп, сук, сэт, св – концентрации соответственно этилового спирта, уксусной кислоты, этилового эфира уксусной кислоты и воды в исходной реакционной смеси, моль/дм3;
 ,
,  ,
,  ,
, 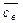 – концентрации соответственно этилового спирта, уксусной кислоты, этилового эфира уксусной кислоты и воды в равновесной реакционной смеси, моль/дм3;
– концентрации соответственно этилового спирта, уксусной кислоты, этилового эфира уксусной кислоты и воды в равновесной реакционной смеси, моль/дм3;
Мсп, Мв, Мэт – молярные массы соответственно спирта этилового, воды, этилового эфира уксусной кислоты, кг/моль;
с – концентрация уксусной кислоты до реакции, моль/дм3;
с1 – концентрация соляной кислоты до реакции, моль/дм3;
с2 – суммарная концентрация соляной и уксусной кислот в равновесной смеси, моль/дм3;
V – суммарный объем реакционной смеси, дм3.
Справочные данные, необходимые для проведения расчета, представлены в табл. 3.1.
Т а б л и ц а 3.1
| Реактивы | Концентрация с, моль/дм3 | Плотность r, кг/м3 | Массовая доля вещества a |
| Раствор уксусной кислоты | 0,24 | ||
| 0,12 | |||
| Раствор соляной кислоты | 0,5 | 0,024 | |
| Спирт этиловый | – | 786,3 | 0,944 |
| Этиловый эфир уксусной кислоты | – |
Расчет константы равновесия
по результатам опытов в колбах № 1 и 2
1. Рассчитать исходные концентрации в реакционной смеси каждой колбы:
– уксусной кислоты сук = сVук /V,
– этилового спирта ссп = Vсп ρсп αсп/МспV,
– воды
св = 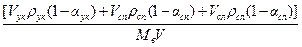 ,
,
поскольку концентрация соляной кислоты невысока, можно принять Vскρск (1 – αск) ≈ Vскρск.
2. Рассчитать равновесные концентрации в реакционной смеси каждой колбы:
– уксусной кислоты  = с2 –
= с2 – 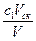 ,
,
– концентрация этилацетата равна уменьшению концентрации уксусной кислоты в реакции  = сук –
= сук –  ,
,
– этилового спирта  ≈ ссп –
≈ ссп –  ,
,
– воды 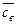 = св +
= св +  .
.
3. По данным, полученным для каждой колбы, определить концентрационную константу равновесия прямой реакции:
Кс = 
Полученные результаты внести в табл. 3.2.
Т а б л и ц а 3.2
| Номер колбы | с 2, моль/дм3 |  ,
моль/дм3 ,
моль/дм3
| 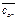 ,
моль/дм3 ,
моль/дм3
|  ,
моль/дм3 ,
моль/дм3
|  ,
моль/дм3 ,
моль/дм3
| Kc | Kc средняя |
Расчет константы равновесия
по результатам опытов в колбах № 3 и 4
1. Рассчитать исходные концентрации в реакционной смеси каждой колбы:
– этилацетата сэт = Vэтρэтαэт/МэтV,
– воды
св =  »
» 
2. Рассчитать равновесные концентрации в реакционной смеси каждой колбы:
– уксусной кислоты  = с 2 –
= с 2 – 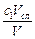 ,
,
– этилового спирта 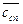 ≈
≈  ,
,
– этилацетата 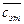 = сэт –
= сэт –  ,
,
– воды 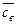 = св –
= св –  .
.
3. Концентрационную константу равновесия прямой реакции определить по формуле:
Кс = 
по данным, полученным для каждой колбы.
Полученные результаты внести в табл. 3.2.
На основании экспериментальных данных рассчитать для исследуемой реакции этерификации среднее значение концентрационной константы равновесия, энергию Гиббса реакции.
Контрольные вопросы и задания
1. Сформулируйте условие равновесия в химической реакции.
2. Запишите уравнение изотермы химической реакции и примените его для оценки направления самопроизвольного протекания реакции.
3. Что такое стандартное химическое сродство? Для чего оно применяется?
4. Проанализируйте влияние температуры на константу равновесия реакции при постоянном давлении или при постоянном объеме.
5. На константы равновесия каких реакций влияет изменение общего давления?
6. Какими методами можно определить константы химического равновесия?
Лабораторная работа № 12
Дата публикования: 2015-07-22; Прочитано: 1567 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
