 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
На химическое равновесие
|
|
Для нахождения зависимости константы равновесия от температуры проводят дифференцирование уравнения изотермы реакции (3.4) по температуре, учитывая, что неравновесные активности заданы и от температуры не зависят,
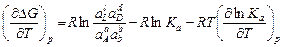 .
.
Подставляя последнее выражение и (3.4) в уравнение Гиббса-Гельмгольца (1.22) для максимальной работы и учитывая, что Кр не зависит от давления и частный дифференциал может быть заменен на полный, получают
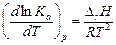 . (3.12)
. (3.12)
Полученное выражение носит название уравнения изобары химической реакции или уравнения изобары Вант-Гоффа.
Аналогичное уравнение получается и для температурной зависимости Кс при использовании в качестве исходного выражения (3.6)
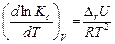 . (3.13)
. (3.13)
Данное выражение называется уравнением изохоры химической реакции или уравнением изохоры Вант Гоффа.
Из уравнений (3.12) и (3.13) следует, что характер зависимости константы равновесия от температуры определяется знаком теплового эффекта процесса. Если реакция экзотермическая (Δ Н < 0, Δ U < 0), идущая с выделением теплоты, то  < 0. Это означает, что повышение температуры приводит к уменьшению константы равновесия, а, следовательно, к снижению содержания продуктов реакции в равновесной реакционной смеси, уменьшению степени превращения в реакции. Для эндотермической реакции, идущей с поглощением теплоты (Δ Н > 0, Δ U > 0), в соответствии с уравнениями (3.12) и (3.13)
< 0. Это означает, что повышение температуры приводит к уменьшению константы равновесия, а, следовательно, к снижению содержания продуктов реакции в равновесной реакционной смеси, уменьшению степени превращения в реакции. Для эндотермической реакции, идущей с поглощением теплоты (Δ Н > 0, Δ U > 0), в соответствии с уравнениями (3.12) и (3.13)  > 0. Это означает, что повышение температуры приводит к увеличению значения константы и, следовательно, к смещению реакции вправо и увеличению степени превращения.
> 0. Это означает, что повышение температуры приводит к увеличению значения константы и, следовательно, к смещению реакции вправо и увеличению степени превращения.
В общем случае повышение температуры смещает равновесие в сторону эндотермической реакции, а уравнения изохоры и изобары являются теоретическим обоснованием принципа Ле Шателье – Гиббса о влиянии температуры на химическое равновесие.
Для установления влияние давления на реакции, протекающие с участием газообразных веществ, воспользуемся константой равновесия, выраженной через равновесные мольные доли,
Kх= f (T, p).
Выражение (3.11), записанное в виде Kх = Kрр- Δ n, логарифмируют и полученное выражение с учетом того, что Kр не является функцией давления, дифференцируют по давлению при постоянной температуре
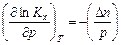 . (3.14)
. (3.14)
Считая газы, участвующие в реакции, идеальными, можно из уравнения Менделеева-Клапейрона выразить изменение числа моль газообразных веществ в реакции Δ n =  и подставить в уравнение (3.14). Тогда
и подставить в уравнение (3.14). Тогда
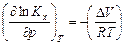 . (3.15)
. (3.15)
Полученные уравнения (3.14) и (3.15) описывают влияние давления на химическое равновесие в идеальной газовой реакции и называются уравнением Планка. Проведем анализ данного уравнения:
1) если реакция протекает с увеличением объема (количества вещества), то при повышении давления Kх уменьшается. Это означает, что для реакций типа А + B = 3 C с ростом давления равновесие смещается в сторону исходных веществ;
2) если реакция протекает с уменьшением объема (количества вещества), то при повышении давления Kх увеличивается. Это означает, что для реакций типа А + 2 B = C с ростом давления равновесие смещается в сторону продуктов реакции;
3) если реакция протекает без изменения объема (количества вещества), то при повышении давления Kх не влияет на равновесие. Это означает, что для реакций типа А + B = 2 C с ростом давления равновесие не изменяется.
Влияние давления на химическое равновесие в растворе незначительно, так как объем раствора практически не изменяется.
Лабораторная работа № 11
Дата публикования: 2015-07-22; Прочитано: 288 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
