 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Задачи для самостоятельного решения. 1. Окисление серы и ее диоксида протекает по уравнениям
|
|
1. Окисление серы и ее диоксида протекает по уравнениям:
а) S(к) + O2 = SO2(г);
б) 2SO2(г) + О2 = 2SO3(г).
Как изменятся скорости этих реакций, если объемы каждой из систем уменьшить в четыре раза?
2. Напишите выражение для константы равновесия гомогенной системы: N2+3H2↔2NH3. Как изменится скорость прямой реакции – образования аммиака, если увеличить концентрацию водорода в три раза?
3. Реакция идет по уравнению N2 + O2 = 2NO. Концентрации исходных веществ до начала реакции были:  = 0,049 моль/л;
= 0,049 моль/л; 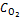 =0,01 моль/л. Вычислите концентрацию этих веществ в момент, когда [NO] = 0,005 моль/л.
=0,01 моль/л. Вычислите концентрацию этих веществ в момент, когда [NO] = 0,005 моль/л.
Ответ: [N2] = 0,0465 моль/л; [O2]= 0,0075 моль/л.
4. Реакция идет по уравнению N2+3H2=2NH3. Концентрации участвующих в ней веществ были:  = 0,80 моль/л;
= 0,80 моль/л;  = 1,5 моль/л;
= 1,5 моль/л; 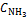 = 0,10 моль/л. Вычислите концентрацию водорода и аммиака, когда [N2] = 0,5 моль/л.
= 0,10 моль/л. Вычислите концентрацию водорода и аммиака, когда [N2] = 0,5 моль/л.
Ответ: [NH3] = 0,70 моль/л; [H2] = 0,60 моль/л.
5. Реакция идет по уравнению H2 + I2 = 2HI. Константа скорости этой реакции при некоторой температуре равна 0,16. Исходные концентрации реагирующих веществ:  =0,04 моль/л;
=0,04 моль/л;  =0,05 моль/л. Вычислите начальную скорость реакции и ее скорость, когда [H2] = 0,03 моль/л.
=0,05 моль/л. Вычислите начальную скорость реакции и ее скорость, когда [H2] = 0,03 моль/л.
Ответ: 3,2 · 10-4; 1,92 · 10-4.
6. Вычислите, во сколько раз уменьшится скорость реакции, протекающей в газовой фазе, если понизить температуру от 120 до 80 оС. Температурный коэффициент скорости реакции 3.
7. Как изменится скорость реакции, протекающей в газовой фазе, при повышении температуры на 60 оС, если температурный коэффициент скорости данной реакции 2?
8. Во сколько раз изменится скорость реакции, протекающей в газовой фазе, при понижении температуры на 300 oС, если температурный коэффициент скорости данной реакции 2?
9. В гомогенной системе СО + Cl2 ↔ COCl2 равновесные концентрации реагирующих веществ: [CO] = 0,2 моль/л; [Cl2] = 0,3 моль/л; [COCl2] = 1,2 моль/л. Вычислите константу равновесия системы и исходные концентрации хлора и СО.
Ответ: К = 20; 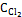 = 1,5 моль/л;
= 1,5 моль/л;  = 1,4 моль/л.
= 1,4 моль/л.
10. В гомогенной системе А + 2В = С равновесные концентрации реагирующих газов: [A] = 0,06 моль/л; [B] = 0,12 моль/л; [C] = =0,216 моль/л. Вычислите константу равновесия системы и исходные концентрации веществ А и В.
Ответ: К = 250; 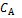 = 0,276 моль/л;
= 0,276 моль/л;  = 0,552 моль/л.
= 0,552 моль/л.
11. В гомогенной газовой системе А + B ↔ C + D равновесие установилось при концентрациях: [B] = 0,05 моль/л и [C] = 0,02 моль/л. Константа равновесия системы равна 0,04. Вычислите исходные концентрации веществ А и В.
Ответ: 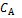 = 0,22 моль/л;
= 0,22 моль/л;  =0,07 моль/л.
=0,07 моль/л.
12. Константа скорости реакции разложения N2O, протекающей по уравнению 2N2O = 2N2 + O2, равна 5 · 10-4. Начальная концентрация N2O = 6,0 моль/л. Вычислите начальную скорость реакции и ее скорость, когда разложится 50 % N2O.
Ответ: 1,8 ·10-2; 4,5 · 10-3.
13. Напишите выражение для константы равновесия гетерогенной системы СО2 + С ↔ 2СО. Как изменится скорость прямой реакции – образования СО, если концентрацию СО2 уменьшить в четыре раза? Как следует изменить давление, чтобы повысить выход СО?
14. Напишите выражение для константы равновесия гетерогенной системы С + Н2О(г) ↔ СО + Н2. Как следует изменить концентрацию и давление, чтобы сместить равновесие в сторону обратной реакции – образования водяных паров?
15. Равновесие гомогенной системы 4НСl(г) + О2 ↔ 2Н2О(г) + + 2Cl2(г) установилось при следующих концентрациях реагирующих веществ: [H2O] = 0,14 моль/л; [Cl2] = 0,14 моль/л; [HCl] = 0,20 моль/л; [O2] = 0,32 моль/л. Вычислите исходные концентрации хлороводорода и кислорода.
Ответ: [HCl]исх = 0,48 моль/л; [O2]исх = 0,39 моль/л.
16. Вычислите константу равновесия для гомогенной системы CO(г) + H2O(г) ↔ CO2(г)+H2(г), если равновесные концентрации реагирующих веществ: [CO] = 0,004 моль/л; [H2O] = 0,064 моль/л; [CO2] = =0,016 моль/л; [H2] = 0,016 моль/л. Чему равны исходные концентрации воды и СО? Ответ: К = 1; = 0,08 моль/л; =0,02 моль/л.
17. Константа равновесия гомогенной системы СО(г) + Н2О(г) ↔ ↔ СО2 + Н2(г) при некоторой температуре равна 1. Вычислите равновесные концентрации всех реагирующих веществ, если исходные концентрации: 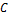 CO= 0,10 моль/л;
CO= 0,10 моль/л;  = 0,40 моль/л.
= 0,40 моль/л.
Ответ: [CO2] = [H2] = 0,08 моль/л; [CO] = 0,02 моль/л; [H2O] = =0,32 моль/л.
18. Константа равновесия гомогенной системы N2 + 3H2 ↔ 2NH3 при некоторой температуре равна 1. Равновесные концентрации водорода и аммиака соответственно равны 0,2 и 0,08 моль/л. Вычислите равновесную и исходную концентрацию азота.
Ответ: [N2] = 8 моль/л;  = 8,04 моль/л.
= 8,04 моль/л.
19. При некоторой температуре равновесие гомогенной системы: 2NO + O2 ↔ 2NO2 установилось при следующих концентрациях реагирующих веществ: [NO] = 0,2 моль/л; [O2] = 0,1 моль/л; [NO2] = =0,1 моль/л. Вычислите константу равновесия и исходную концентрацию NO и О2.
Ответ: К = 2,5;  = 0,3 моль/л;
= 0,3 моль/л; 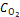 = 0,15 моль/л.
= 0,15 моль/л.
20. Почему при изменении давления смещается равновесие системы N2 + 3H2 ↔ 2NH3 и не смещается равновесие системы N2 + O2 ↔ ↔2NO? Ответ мотивируйте на основании расчета скорости прямой и обратной реакции в этих системах до, и после изменения давления. Напишите выражения для констант равновесия каждой из данных систем.
21. Исходные концентрации в гомогенной системе
2NO + Cl2 ↔ 2NOCl составляют соответственно 0,5 и 0,2 моль/л. Вычислите константу равновесия, если к моменту наступления равновесия прореагировало 20 % NO.
Ответ: 0,416.
22. Во сколько раз изменится скорость реакции 2А + В ↔ А2В, если концентрацию вещества А увеличить в 2 раза, а концентрацию вещества В уменьшить в два раза?
Ответ: возрастает в 2 раза.
23. Через некоторое время после начала реакции 3A + B ↔ 2C + D концентрации веществ составляли: [А] = 0,03 моль/л; [В] = 0,01 моль/л; [С] = 0,008 моль/л. Каковы исходные концентрации веществ А и В?
Ответ: 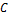 А = 0,042 моль/л;
А = 0,042 моль/л; 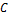 В = 0,014 моль/л.
В = 0,014 моль/л.
24. В системе СО + Cl2 ↔ СОCl2 концентрацию СО увеличили от 0,03 до 0,12 моль/л, а концентрацию хлора – от 0,02 до 0,06 моль/л. Во сколько раз возросла скорость прямой реакции?
Ответ: в 12 раз.
25. Как изменится скорость реакции 2NO(г) + О2(г) ↔ 2NO2(г), если:
а) увеличить давление в системе в 3 раза;
б) уменьшить объём системы в 3 раза;
в) повысить концентрацию NO в 3 раза?
Ответ мотивируйте на основании расчета скорости прямой реакции до и после изменения условий.
26. Чему равен температурный коэффициент скорости реакции, если при увеличении температуры на 30 градусов скорость реакции возрастает в 15,6 раза?
Ответ: 2,5.
27. Температурный коэффициент скорости некоторой реакции равен 2,3. Во сколько раз увеличится скорость этой реакции, если повысить температуру на 25 градусов?
Ответ: в 8 раз.
28. Равновесие в системе Н2(г) + I2(г) ↔ 2НI(г) установилось при следующих концентрациях: [H2] = 0,025 моль/л; [I2] = 0,005 моль/л; [HI] = 0,09 моль/л. Определить исходные концентрации йода и водорода.
Ответ: 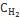 = 0,07 моль/л;
= 0,07 моль/л;  = 0,05 моль/л.
= 0,05 моль/л.
29. В каком направлении сместятся равновесия:
2СО(г) + О2(г) ↔ 2СО2(г); ∆fН = - 566 кДж;
N2(г) + О2(г) ↔ 2NО(г); ∆fН = 180 кДж
а) при понижении температуры; б) при повышении давления?
30. Как повлияет на равновесие следующих реакций:
2Н2(г) + О2(г)↔2Н2О(г); ∆fН = – 483,6 кДж;
СаСО3(к) ↔ СаО(к) + СО2(г); ∆fН =179 кДж
а) повышение давления; б) повышение температуры?
31. Указать, какими изменениями концентраций реагирующих веществ и давления можно сместить вправо равновесие реакции
СО2(г) + С(графит) ↔2СО(г).
32. В загрязненном воздухе содержится примесь CO, которая образуется при неполном сгорании твердого топлива и при работе двигателей внутреннего сгорания. Монооксид углерода медленно окисляется кислородом воздуха до диоксида углерода. При определенных условиях скорость такой реакции составляет 0,05 моль/(л.с), а концентрация CO2 становится равной 0,2 моль/л. Рассчитайте концентрацию CO2 через 10 с после указанного момента.
Ответ: 0,7 моль/л.
33. Один из важных видов сырья для органического синтеза – «водяной газ», смесь водорода и монооксида углерода, которая получается при пропускании водяного пара через башни, наполненные раскаленным углем. Водяной газ служит для получения метанола, формальдегида и других химических продуктов. Рассчитайте значение константы скорости реакции получения водяного газа, если при концентрации H2O, равной 0,03 моль/л, скорость реакции составляет 6,1. 10--5 моль/(л.с).
Ответ: 2,0. 10-3 с-1.
34. Атмосферные загрязнения постепенно уничтожают защитный озоновый слой Земли. В реакциях разложения озона участвуют многие газы, но прежде всего оксиды азота. Взаимодействие монооксида азота с озоном приводит к образованию дикислорода и диоксида азота. Рассчитайте скорость этой реакции, если через 25 с после начала реакции молярная концентрация озона была 0,8 моль/л, а через 55 с (от начала реакции) стала равна 0,02 моль/л.
Ответ: 0,026 моль/(л с).
35. На больших высотах солнечное излучение вызывает диссоциацию молекул кислорода на атомы. Столкновение атомов кислорода и молекул дикислорода приводит к образованию озона, слой которого защищает Землю от коротковолнового излучения Солнца, смертельно опасного для живых организмов. Определите скорость этой реакции, если через 1 мин после ее начала концентрация озона была равна
0,024 моль/л, а через 2 мин после этого момента − 0,064 моль/л.
Ответ: 6,7. 10-4 моль/(л с).
36. Причиной образования опасного для здоровья тумана – «смога» −считают большое количество выхлопных газов автомобилей при высокой влажности воздуха. Помимо озона, в смоге присутствует ядовитый диоксид азота, который получается по реакции монооксида азота с атомарным кислородом. Рассчитайте скорость этой реакции, если через 5 минут после ее начала концентрация диоксида азота стала равна 0,05 моль/л, а через 20 минут − 0,08 моль/л.
Ответ: 3,3. 10-5 моль/(л с).
37. В гетерогенных химических системах при постоянных термодинамических параметрах установилось состояние равновесия:
а) TiO2(т) + 2C(т) + 2Cl2(г) ↔ TiCl4(г) + 2CO(г)
б) Mg3N2(т) + 6H2O(г) ↔ 3Mg(OH)2(т) + 2NH3(г)
в) Si(т) + 2H2O(г) ↔ SiO2(т) + 2H2(г)
г) CS2(г) + 2Cl2(г) ↔ CCl4(г) + 2S(т)
д) 2NO2(г) + 2S(т) ↔ N2(г) + 2SO2(г)
e) 10NO(г) + P4(г) ↔ 5N2(г) + P4O10(г)
На основании закона действующих масс составьте выражение для константы равновесия.
38.На основании принципа Ле Шателье определите, в каком направлении сместится равновесие в следующих системах при повышении температуры:
a) 2NO(г) + O2(г) ↔ 2NO2(г); ∆ Н ° < 0;
б) 2SO3(г) ↔ 2SO2(г) + O2(г); ∆ Н ° > 0;
в) C(т) + CO2(г) ↔ 2CO(г); ∆ Н ° > 0;
г) 2NH3(г) ↔ N2(г) + 3H2(г); ∆ Н ° > 0;
д) C(т) + 2Cl2(г) ↔ CCl4(г); ∆ Н ° < 0;
е) C(т) + 2N2O(г) ↔ CO2(г) + 2N2(г); ∆ Н ° < 0.
39. На основании принципа Ле Шателье определите, в каком направлении сместится равновесие в следующих системах при повышении давления (Т = const):
a) 2Fe(т) + 3H2O(г) ↔ Fe2O3(т) + 3H2(г)
б) C3H8(г) + 5O2(г) ↔ 3CO2(г) + 4H2O(г)
в) CO2(г) + 2N2(г) ↔ C(т) + 2N2O(г)
г) CO(г) + Cl2(г) ↔ CCl2O(г)
д) CH4(г) + 4S(т) ↔ CS2(г) + 2Н2S(г)
е) N2H4(г) + O2(г) ↔ N2(г) + 2H2O(г)
40. На основании принципа Ле Шателье определите, увеличится ли выход продуктов при одновременном понижении температуры и давления в системах:
a) С(т) + O2(г) ↔ СO2(г); ∆ Н ° < 0;
б) Н2(г) + I2(т) ↔ 2HI(г); ∆ Н ° > 0;
в) 6HF(г) + N2(г) ↔ 2NF3(г) + 3H2(г); ∆ Н ° > 0;
г) 2O3(г) ↔ 3O2(г); ∆ Н ° < 0;
д) 2CO(г) ↔ 2C(т) + O2(г); ∆ Н ° > 0;
е) I2(т) + 5CO2(г) ↔ I2O5(т) + 5CO(г); ∆ Н ° > 0.
41. На основании принципа Ле Шателье определите, увеличится ли выход продуктов при повышении температуры и понижении давления одновременно:
a) С(т) + H2O(г) ↔ СO(г) + H2(г); ∆ Н ° > 0;
б) 2NO(Cl)(г) + Br2(г) ↔ 2NO(Br)(г) + Cl2(г); ∆ Н ° > 0;
в) CO(г) + 2H2(г) ↔ CH3OH(г); ∆ Н ° < 0;
г) N2O4(г) ↔ 2NO2(г); ∆ Н ° > 0;
д) 8H2S(г) + 8I2(т) ↔ S8(т) + 16HI(г); ∆ Н ° > 0;
е) 2CO(г) + O2(г) ↔ 2CO2(г); ∆ Н ° < 0.
Согласно заданному варианту выберете номера задач по таблице 2.10 и решите их.
Таблица 5.1 – Варианты задач для самостоятельного решения
| Вариант | 1 (19) | 2 (20) | 3 (21) | 4 (22) | 5 (23) | 6 (24) | 7 (25) | 8 (26) | 9 (27) |
| Номер задач | 1, 19, 37а, 40а | 2, 20, 37б, 40б | 3, 21, 37в, 40в | 4, 22, 37г, 40г | 5, 23, 37д, 40д | 6, 24, 37е, 40е | 7, 25, 38а, 41а | 8, 26, 38б, 41б | 9, 27, 38в, 41в |
| Вариант | 10 (28) | 11 (29) | 12 (30) | 13 (31) | 14 (32) | 15 (33) | 16 (34) | 17 (35) | 18 (36) |
| Номер задач | 10, 28, 38г, 41г | 11, 29, 38д, 41д | 12, 30, 38е, 41е | 13, 31, 39а, | 14, 32, 39б, | 15, 33, 39в, | 16, 34, 39г, | 17, 35, 39д, | 18, 36, 39е, |
ТЕСТЫ
1. Чтобы сместить вправо равновесие химической реакции:
N2(г) + 3H2(г) ↔ 2NH3(г), ∆ H < 0
Необходимо:
а) увеличить давление;
б) уменьшить давление;
в) повысить температуру;
г) понизить температуру;
д) увеличить концентрацию аммиака;
е) уменьшить концентрацию аммиака
2. Введение катализатора в систему, находящуюся в состоянии равновесия:
а) смещает равновесие в сторону продуктов реакции;
б) смещает равновесие в сторону исходных веществ;
в) не влияет на состояние равновесия;
г) смещает равновесие в сторону экзотермической реакции;
д) смещает равновесие в сторону эндотермической реакции.
3. Для смещения влево равновесия в системе
CO2(г) + С(графит) ↔ 2СO(г); ∆ H >0
следует:
а) повысить температуру;
б) понизить температуру;
в) повысить давление;
г) понизить давление;
д) ввести катализатор.
4. k 1 и k 2 − соответственно константы скоростей прямой и обратной реакций. Скорость обратной химической реакции 2NO2 ↔ 2NO+ + O2 равна:
а) [NO2]2;
б) k 2∙[NO]∙[O2]2;
в) k 1∙[NO2]2;
г) k 2∙([NO]2 + [O2]);
д) k 2∙[NO]2∙[O2];
е) k 2∙[NO]∙[O2].
5. Найдите порядок химической реакции
СН3СООСН3 + Н2О(избыток) = СН3СООН + СН3ОН.
Введите ответ числом.
6. Реакция 2SO2(г) + O2(г) = 2 SO3(г) протекает в присутствии V2O5. Эта реакция является примером:
а) гетерогенного катализа;
б) гомогенного катализа;
в) некаталитической реакции;
г) кислотно-основного катализа;
д) цепной реакции;
е) ферментативного катализа;
ж) автокатализа.
7. Константа равновесия реакции CO(г) + H2(г) ↔ H2O(г) + C(т) равна:
а) К р = [H2O]/[CO][H2];
б) К р = [CO] / [C];
в) К р = 1/[H2O];
г) К р = [CO]/ [H2O];
д) К р = [CO].
8. Установите соответствие
| Воздействующий фактор | Смещение равновесия |
| 1) повышение давления; | а) в сторону меньшего объема системы; |
| 2) повышение температуры; | б) в сторону эндотермического процесса; |
| 3) повышение концентрации. | в) в сторону конечных продуктов реакции исходных веществ. |
9. Если образец карбоната магния растворяется в серной кислоте при 25 оС за 16 секунд, а при 55 оС за 2 секунды, то температурный коэффициент скорости реакции равен:
а) 2,67;
б) 0,5;
в) 8;
г) 2.
10. Образование коллоидного раствора происходит путем
а) конденсирования частиц;
б) седиментации частиц;
в) диспергирования частиц;
г) коагуляции частиц.
11. Адсорбционный слой противоионов в формуле мицеллы йодида серебра записывается в виде:
а) x K+;
б) n I-;
в) m [ AgI ];
г) (n - х) К+.
12. Явление переноса частиц дисперсной фазы в постоянном электрическом поле называется
а) электроосмос;
б) электрофорез;
в) потенциал течения;
г) электролиз.
Дата публикования: 2015-07-22; Прочитано: 990 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
