 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Примеры решения задач. Задача 1. Во сколько раз изменится скорость прямой реакции n2(г)+3н2(г)↔ 2nh3(г), если давление в системе увеличить в 2 раза?
|
|
Задача 1. Во сколько раз изменится скорость прямой реакции N2(г)+3Н2(г)↔ 2NH3(г), если давление в системе увеличить в 2 раза?
Решение
Увеличение давления в системе в 2 раза равносильно уменьшению объема системы в 2 раза. При этом концентрации реагирующих веществ возрастут в 2 раза. Согласно закону действующих масс, начальная скорость реакции равна υн = k ∙[N2]∙[H2]3. После увеличения давления в 2 раза концентрации азота и водорода увеличатся в 2 раза, и скорость реакции станет равна υк = k ∙2[N2]∙23[H2]3 = k ∙16[N2]∙[H2]3. Отношение υ к ./υн показывает, как изменится скорость реакции после изменения давления. Следовательно, υ к /υн = k ∙16[N2]∙[H2]3/ k ∙[N2]∙[H2]3=16.
Ответ: скорость реакции увеличится в 16 раз.
Задача 2. Во сколько раз изменится скорость прямой и обратной реакции в системе: 2SO2(г) + O2(г) ↔2SO3(г), если объем газовой смеси уменьшить в три раза? В какую сторону сместится равновесие системы?
Решение
Обозначим концентрации реагирующих веществ: [SO2] = а,
[O2] = b, [SO3] = c. Согласно закону действия масс, скорости и прямой и обратной реакций до изменения объема
υпр = k · а 2· b; υобр = k 1· с 2.
После уменьшения объема гомогенной системы в три раза концентрация каждого из реагирующих веществ увеличится в три раза: [SO2] = 3 a, [O2] = 3 b, [SO3] = 3 c. При новых концентрациях скорости υ' прямой и обратной реакций: υ'пр = k ·(3 a)2·(3 b) = 27· k · a 2· b; υ'обр= k 1·(3 с)2= = 9· k 1· с 2. Отсюда

Следовательно, скорость прямой реакции увеличилась в 27 раз, а обратной – только в девять раз. Равновесие системы сместилось в сторону образования SO3.
Задача 3. В реакции С(т)+2H2(г) ↔ CH4(г) концентрацию водорода уменьшили в 3 раза. Как изменится скорость реакции?
Решение
Согласно закону действующих масс, начальная скорость реакции равна υн= k ∙[H2]2. После уменьшения концентрации водорода в 3 раза скорость станет равна υк= k ∙(1/3)2[H2]2 =1/9 k [H2]2. После изменения концентрации водорода скорость изменится следующим образом: υк/υн=1/9 k [H2]2/ k [H2]2=1/9.
Ответ: скорость реакции уменьшится в 9 раз.
Задача 4. Во сколько раз возрастет скорость реакции при повышении температуры с 10 до 30 oС (γ = 3)?
Решение
При увеличении температуры с 10 до 30 oС скорость реакции в соответствии с правилом Вант-Гоффа возрастает:
υ2/υ1=γ(t2-t1)/10,
где t 2=30 oC, t 1=10 oC, а υ2 и υ1 – скорости реакции при данных температурах.
Получаем υ2/υ1=3(30–10)/10=32=9, т.е. скорость реакции увеличится в 9 раз.
Ответ: 9.
Задача 5. Вычислите, во сколько раз увеличится скорость реакции, протекающей в газовой фазе, при повышении температуры от 30 до 70 oС, если температурный коэффициент реакции равен 2.
Решение
Зависимость скорости химической реакции от температуры определяется эмпирическим правилом Вант-Гоффа по формуле
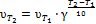 .
.

Следовательно, скорость реакции при температуре 70 oС больше скорости реакции при температуре 30 oС в 16 раз.
Задача 6. Равновесие реакции 2H2(г)+O2(г) ↔ 2H2O(г); ∆ H <0 смещается вправо:
1) при уменьшении давления; 2) при увеличении давления?
Решение
Все вещества в системе – газы. В соответствии с принципом Ле Шателье, повышение давления приводит к смещению равновесия в сторону реакции, приводящей к меньшему количеству молей газов, т.е. в сторону образования Н2О. Следовательно, повышение давления в системе смещает равновесие реакции вправо.
Ответ: при увеличении давления.
Задача 7. В какую сторону сместится равновесие реакции 2SO2(г)+O2(г)↔ 2SO3(г); ∆ H <0 при повышении температуры?
Решение
Поскольку ∆ H <0, теплота выделяется в ходе прямой реакции, которая является экзотермической. Обратная реакция будет эндотермической. Повышение температуры всегда благоприятствует протеканию реакции с поглощением теплоты, т.е. равновесие сместится в сторону исходных веществ.
Ответ: влево.
Задача 8. Определите константу равновесия реакции NOCl2(г)+NO(г) ↔ 2NOCl(г), если при некоторой температуре равновесные концентрации веществ составляют [NOCl2]=0,05; [NO]=0,55; [NOCl]=0,08 моль/л.
Решение
Константа равновесия обратимой химической реакции равна отношению произведения равновесных концентраций продуктов к произведению равновесных концентраций исходных веществ. Значение каждой из концентраций должно быть возведено в степень, равную стехиометрическому коэффициенту перед соответствующим веществом в уравнении реакции. Поэтому
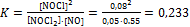 .
.
Ответ: 0,233.
Задача 9. Эндотермическая реакция разложения пентахлорида фосфора протекает по уравнению:
РСl5(г)↔ РСl3(г)+Сl2(г); ∆ Н = + 92,59 кДж.
Как надо изменить: а) температуру; б) давление; в) концентрацию, чтобы сместить равновесие в сторону прямой реакции – разложения РСl5?
Решение
Смещением, или сдвигом химического равновесия, называют изменение равновесных концентраций реагирующих веществ в результате изменения одного из условий реакции. Направление, в котором сместилось равновесие, определяется по принципу Ле Шателье: а) так как реакция разложения PCl5 эндотермическая (∆ Н > 0), то для смещения равновесия в сторону прямой реакции нужно повысить температуру; б) так как в данной системе разложение PCl5 ведет к увеличению объема газообразных веществ (из одной молекулы газа образуются две газообразные молекулы), то для смещения равновесия в сторону прямой реакции надо уменьшить давление; в) смещение равновесия в указанном направлении можно достигнуть как увеличением концентрации PCl5, так и уменьшением концентрации PCl3 или Cl2.
Задача 10. Один моль аммиака поместили в сосуд объемом 20 л и нагрели до 600 oC. Давление в сосуде оказалось равным 435 кПа. Рассчитайте степень разложения аммиака.
Дата публикования: 2015-07-22; Прочитано: 3618 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
