 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Решение. Соотношение количества веществ (моль) соответствует соотношению их коэффициентов в уравнении
|
|
Первый случай:
| A + | B = | 2C. |
Соотношение количества веществ (моль) соответствует соотношению их коэффициентов в уравнении. Если С стало на 2 моль больше (5 из 3), то количество А и В уменьшились на 1 моль каждое. В результате при установлении равновесия стало 5 моль С, по 2 моль А и В.
Константа равновесия:
К = [С] 2/([А][В]) = 25/2∙2 = 6,25
Второй случай:
Мольное соотношение то же, примем за х число молей прореагировавших А и В (они одинаковы):
| x | x 2 x | |
| A + | B = 2C |
К = (1+2 х) 2 /{(3- х)(2- х)} = 6,25.
х = 1,115.
Ответ:Мольные доли веществ в равновесной смеси:
(А) = (3-1,115)/6 = 0,314;
(В) = (2-1,115)/6 = 0,148;
(С) = 0,538.
Задача 12. Константа равновесия реакции N2 + 3H2 ↔ 2NH3 равна 0,1 (при 400 oС). Равновесные концентрации [Н2] = 0,2 моль/л и [NН3] = 0,08 моль/л. Вычислить начальную и равновесную концентрации азота.РешениеЗаписываем выражение для константы равновесия К: K = ([NH3]2/ ([N2]∙[H2]3)Подставляем в выражение для К данные задачи:0,1 = (0,082/ ([N2]∙0,23)Отсюда рассчитываем равновесную концентрацию [N2] = 8 моль/лДалее находим начальную концентрацию азота, учитывая, что из одного моль азота согласно уравнению реакции образуется 2 моль аммиака, т.е. для получения 0,08 моль аммиака требуется 0,04 моль азота. Таким образом, начальная концентрация азота [N2] = 8 + 0,04 =8,04 моль/л.Ответ: Равновесная концентрация азота 8 моль/л, начальная – 8,04 моль/л. Задача 13. Некоторая реакция при 0 oС протекает практически до конца за 4,5 часа (∼16384 с = 214 с). При какой температуре реакция пройдет практически до конца в 1 с (температурный коэффициент скорости равен 2).РешениеПодставляем данные задачи в формулу (1.5):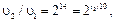 находим t 2/10 = 14. Отсюда: t 2 = 140 oС.Ответ: t 2 = 140 oС.
Задача 14. Во сколько раз увеличится скорость реакции, протекающей при 300 К, если энергию активации уменьшить на 7 кДж/моль. РешениеВоспользуемся уравнением (1.6). Запишем его для двух скоростей реакций при двух разных энергиях активации, отличающихся на 7 кДж, и поделим одно на другое:
находим t 2/10 = 14. Отсюда: t 2 = 140 oС.Ответ: t 2 = 140 oС.
Задача 14. Во сколько раз увеличится скорость реакции, протекающей при 300 К, если энергию активации уменьшить на 7 кДж/моль. РешениеВоспользуемся уравнением (1.6). Запишем его для двух скоростей реакций при двух разных энергиях активации, отличающихся на 7 кДж, и поделим одно на другое: 
Ответ: В 16,6 раза.
Задача 15. При 37 oС реакция заканчивается за 150 с, а при 47 oC – за 75 с. Вычислить энергию активации. РешениеНайдем энергию активации по формуле (1.7). = 57,1 кДж/моль.
= 57,1 кДж/моль. Ответ: 57,1 кДж/моль.
Дата публикования: 2015-07-22; Прочитано: 544 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
