 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Ионные равновесия. Определение степени и константы диссоциации слабых электролитов, коэффициента электропроводности (кажущейся степени диссоциации) сильных электролитов
|
|
Для количественного описания процесса диссоциации растворенных веществ на ионы можно использовать законы химического равновесия, применяемые к химическим реакциям при постоянных температуре и давлении или температуре и объеме. В растворах слабых электролитов ионное равновесие устанавливается между недиссоциированными молекулами и ионами при любой концентрации и подчиняется закону действия масс. Рассмотрим диссоциацию молекул слабого электролита на два однозарядных иона:
КА + Н2О ↔ К+ + А-
Согласно закону действия масс имеем:
К =  (1.3.1)
(1.3.1)
Активность воды в разбавленных растворах практически постоянна, поэтому произведение  =const обозначают КД и называют термодинамической константой диссоциации:
=const обозначают КД и называют термодинамической константой диссоциации:
КД,а = 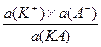 (1.3.2)
(1.3.2)
Если концентрация слабого электролита мала, вместо активностей можно брать значения молярной концентрации и уравнение (3.2) примет вид:
КД,с = 
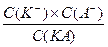 (1.3.3)
(1.3.3)
Пусть степень диссоциации электролита при заданной молярной концентрации С равна αС. В состоянии равновесия С(К+) = С(А-) = αС С;
С(КА) = (1 - αС) С, тогда
КД,с = 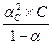 (1.3.4)
(1.3.4)
Полученное выражение является математическим описанием закона разведения Оствальда. Так как αС =  , то
, то
КД,с = 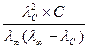 (1.3.5)
(1.3.5)
Величину КД,с называют классической константой диссоциации, условной константой диссоциации и т. п. Она имеет постоянное значение только для очень разбавленных растворов, когда средний ионный коэффициент активности γ±→1. Для растворов электролитов типа КА с малой ионной силой
КД,а = КД,с γ±2 (1.3.6)
Зная константу диссоциации, можно рассчитать изменение стандартных значений термодинамических функций при электролитической диссоциации. Стандартное изменение изобарно-изотермического потенциала (энергии Гиббса) ΔGД0 вычисляют для стандартных условий, когда  , по уравнению:
, по уравнению:
ΔGД0 = -RT lg КД,а = -19,148 T lg КД,а, Дж/моль (1.3.7)
Стандартное изменение энтальпии ΔНД0 определяют по значениям двух констант диссоциации, полученных для температур Т1 и Т2.
ΔНД0 = 2,303 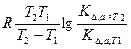 , Дж/моль (1.3.8)
, Дж/моль (1.3.8)
Стандартное изменение энтропии ΔSД0 вычисляют по полученным значениям энергии Гиббса и энтальпии:
ΔSД0 = (ΔНД0 - ΔGД0) / Т (1.3.9)
Пример 1. Сопротивление 0,05Н раствора нитрата серебра при 18оС, измеренное в сосуде с электродами, емкость сопротивления которых 0,5 см-1 равно 100 Ом. Найдите удельную электропроводность и коэффициент электропроводности fλ электролита. (Подвижности ионов даны в приложении, табл.1).
Решение: Емкость сопротивления электродов в электролитической ячейке представляет собой не что иное, как константу сосуда l/s =0,5 см-1.
Удельная электропроводность связана с константой сосуда K и сопротивлением R соотношением: κ = К/R, следовательно, κ = 0,5/100 = 5 10-3 См/см.
Коэффициент электропроводности или кажущаяся степень диссоциации электролита может быть рассчитана по формуле: fλ = λС/λ∞. При этом предельное значение эквивалентной электропроводности λ∞ = λ(Ag+) + λ(NO3-). Воспользовавшись справочными данными, получим:
λ∞ = 54 + 61,6 = 115,6 См см2/моль
Эквивалентная электропроводность при заданной концентрации электролита λС = 1000 κ/СЭ, λС = 103×5×10-3/0,05 = 100 См см2/моль.
Величина коэффициента электропроводности: fλ=100/115,6 =0,865 или 86,5%
Пример 2. Удельная электропроводность водного раствора уксусной кислоты с концентрацией 0,1 моль/л имеет величину 0,000471 См/см. Эквивалентная электропроводность уксусной кислоты при бесконечном разведении 389 См см2/моль. Определите степень и константу диссоциации кислоты.
Решение: α = λС/λ∞. При этом λС = 1000 κ/СЭ,
λС = 103×4,71×10-4/10-1=4,71 См см2/моль и α = 4,71/389 =0,012 или 1,2%. Константа диссоциации
КД,с = 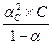 , КД,с=(0,012)2 ×0,1/(1- 0,012) = 1,45 10-5
, КД,с=(0,012)2 ×0,1/(1- 0,012) = 1,45 10-5
Дата публикования: 2015-07-22; Прочитано: 705 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
