 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Уровни организации белковых молекул
|
|
(структура белков)
Существует 4 уровня организации белковых молекул:
· Первичная структура
Первичная структура белка представляет собой полипептидную цепь, состоящую из аминокислотных остатков, соединенных пептидными связями:
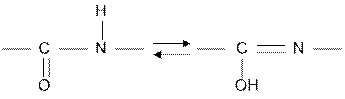
кетоформа енольная форма
Пептидная связь характеризуется следующими свойствами:
1) атомы О и Н пептидной связи имеют трансориентацию;
2) четыре атома пептидной связи лежат в одной плоскости, т.е. для пептидной связи характерна компланарность;
3) пептидная связь в молекуле белка проявляет кето-енольную таутомеризацию;
4) длина C-N-связи, равная 0,13 нм, имеет промежуточное значение между длиной двойной ковалентной связи (0,12 нм) и одинарной ковалентной связи (0,15 нм), из чего следует, что вращение вокруг оси C-N затруднено;
5) пептидная связь прочнее обычной ковалентной, т.к. она является полуторной (из-за перераспределения электронной плотности).
Для каждого индивидуального белка последовательность аминокислот в полипептидной цепи является уникальной. Она определяется генетически и в свою очередь определяет более высокие уровни организации данного белка.
Аминокислотный остаток, находящийся на том конце цепи, где имеется свободная аминогруппа, называется аминоконцевым, или N-концевым, а остаток на другом конце, несущем свободную карбоксильную группу, -карбоксиконцевым, или С-концевым. Название полипептида начинается с N-конца.
· Вторичная структура
Вторичная структура белка представляет собой способ укладки полипептидной цепи в упорядоченную форму за счет системы водородных связей. Полипептидная цепь самопроизвольно скручивается и приобретает более энергетически выгодную форму. Вторичная структура белков имеет две основные разновидности:
1) α–спираль (как правило, правозакрученная); стабилизируется между кислородом карбонильной группой и водородом аминогруппы.
Между Н и О образуется водородная связь. Она слабая, но поскольку этих связей много, то эта структура устойчивая. Каждая пептидная группа участвует в образовании 2-х водородных связей.
Гидрофильные радикалы R оказываются наружу, а гидрофобные радикалы R1 находятся внутри спирали (прячутся внутрь от растворителя).
2) β – складчатый слой. При образовании этой структуры несколько полипептидных цепей, не сворачиваясь в α-спираль, связываются межцепочечными водородными связями. Например, такой структурой обладают β-кератины (входят в состав шелка). β-складчатая структура возникает между смежными полипептидными цепями. Складчатые листы могут быть образованы параллельными (N-концы направлены в одну сторону) и антипараллельными полипептидными цепями (N-концы направлены в разные стороны).
При взаимодействии между собой вторичных структур может образовываться сверхвторичная структура (суперспираль). Например, суперспирализованная α-спираль встречается в фибриллярных белках.
· Третичная структура
Третичная структура белков представляет собой глобулу и характерна для глобулярных белков. На третичном уровне организации возникает активный центр и белок приобретает функциональную активность.
Связи, стабилизирующие третичную структуру:
1) дисульфидная (возникает между радикалами цистеина; эта связь прочная, но способна легко восстанавливаться);
2) ионная (образуется между заряженными радикалами аминокислот);
3) водородная (возникает между радикалами полярных аминокислот);
4) изопептидная (образуется между карбоксильной и аминогруппой радикала);
5) гидрофобное взаимодействие (между гидрофобными аминокислотами).
У глобулы полярные радикалы в гидратированном состоянии находятся снаружи, гидрофобные радикалы внутри.
В пределах глобулы часто выделяют домены – участки полипептидной цепи, которые самостоятельно от других участков той же цепи образуют структуру, во многом напоминающую глобулярный белок. В пределах одной полипептидной цепи может встречаться несколько доменов.
· Четвертичная структура
Четвертичная структура характерна только для олигомерных белков (олигомерные белки – белки, состоящие из нескольких полипептидных цепей).
Протомер – полипептидная цепь в составе олигомерного белка.
Четвертичная структура – характерный способ расположения протомеров олигомерного белка. Активный центр возникает при объединении протомеров.
К примеру, четвертичной структурой обладает гемоглобин – белок крови, содержащийся в эритроцитах (переносит кислород); его молекула имеет 2α- и 2 β-протомера.
Дата публикования: 2014-10-19; Прочитано: 1878 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
