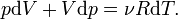|
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Вопрос №4 (с доп. материалом)
|
|
Предисловие (не относящееся к вопросу. Но по этой же теме и это нужно знать)
Адиабатический, или адиабатный процесс — термодинамический процесс в макроскопической системе, при котором система не обменивается тепловой энергией с окружающим пространством.
Дополнение к вопросу №4, не относящееся к вопросу, но по этой же теме и это нужно знать:
Внутренняя энергия – функции состояния системы или вещества. Не зависит от того, каким образом система переходит в это состояние, а зависит только от начального и конечного положения.
Внутренняя энергия системы – полная энергия системы, за вычетом Екин системы в целом и за вычетом потенциальной энергии системы в поле внешних сил.
U=Eполн. - Eвнеш.
U= 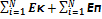 Идеальный газ – газ, взаимодействием и размерами которого можно пренебречь.
Значит,
Идеальный газ – газ, взаимодействием и размерами которого можно пренебречь.
Значит, 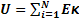 Кинетическая энергия движения молекул определяется температурой.
Особенности:
1)Внутренняя энергия системы является функцией состояния и однозначно определяется параметрами системы;
2)Внутренняя энергия – величина аддитивная.
Кинетическая энергия движения молекул определяется температурой.
Особенности:
1)Внутренняя энергия системы является функцией состояния и однозначно определяется параметрами системы;
2)Внутренняя энергия – величина аддитивная.
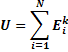 Для 1 моль вещества: U=(i/2)*K*T*Na
K*Na=R, U(1 моль)=(i/2)*R*T
При n моль, dU = (i/2)*n*R*dT
dU - Внутренняя энергия, записанная через число степеней свободы.
Внутреннюю энергию можно изменить двумя способами:
1)совершить над системой работу;
2)сообщить ей некоторое количество теплоты.
Для 1 моль вещества: U=(i/2)*K*T*Na
K*Na=R, U(1 моль)=(i/2)*R*T
При n моль, dU = (i/2)*n*R*dT
dU - Внутренняя энергия, записанная через число степеней свободы.
Внутреннюю энергию можно изменить двумя способами:
1)совершить над системой работу;
2)сообщить ей некоторое количество теплоты.
|
Если термодинамический процесс в общем случае являет собой три процесса — теплообмен, совершение системой (или над системой) работы и изменение её внутренней энергии, то адиабатический процесс в силу отсутствия теплообмена (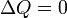 ) системы со средой сводится только к последним двум процессам. Поэтому, первое начало термодинамики в этом случае приобретает вид
) системы со средой сводится только к последним двум процессам. Поэтому, первое начало термодинамики в этом случае приобретает вид
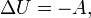
где  — изменение внутренней энергии тела,
— изменение внутренней энергии тела, 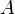 — работа, совершаемая системой.
— работа, совершаемая системой.
Изменения энтропии S системы в обратимом адиабатическом процессе вследствие передачи тепла через границы системы не происходит[8]:
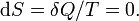
Здесь  — температура системы,
— температура системы, 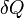 — теплота, полученная системой.
— теплота, полученная системой.
Вывод уравнения:
Согласно закону Менделеева — Клапейрона справедливо соотношение
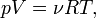
где R — универсальная газовая постоянная. Продифференцировав обе части, получаем
|
Получаем, 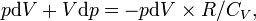
Количество теплоты – количество энергии, передаваемое системе при тепловом контакте без совершения работы.
Первое начало термодинамики:
Закон сохранения энергии применительно к тепловым процессам.
Q = dU + A
Применение первого начала термодинамики к изопроцессам:
Изохорный процесс (V = const): газ работы не совершает, A = 0. Следовательно,
Здесь U (T1) и U (T2) – внутренние энергии газа в начальном и конечном состояниях. Внутренняя энергия идеального газа зависит только от температуры (закон Джоуля). При изохорном нагревании тепло поглощается газом (Q > 0), и его внутренняя энергия увеличивается. При охлаждении тепло отдается внешним телам (Q < 0). Изобарный процесс (p = const): работа, совершаемая газом, выражается соотношением
Первый закон термодинамики для изобарного процесса дает:
При изобарном расширении Q > 0 – тепло поглощается газом, и газ совершает положительную работу. При изобарном сжатии Q < 0 – тепло отдается внешним телам. В этом случае A < 0. Температура газа при изобарном сжатии уменьшается, T2 < T1; внутренняя энергия убывает, ΔU < 0. Изотермический процесс: температура газа не изменяется, следовательно, не изменяется и внутренняя энергия газа, ΔU = 0. Первый закон термодинамики для изотермического процесса выражается соотношением
|
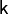 :
:
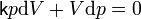 .
.
Это уравнение можно переписать в виде
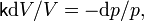
что после интегрирования даёт уравнение
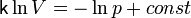 .
.
Окончательно получаем

Дата публикования: 2014-11-18; Прочитано: 250 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!