 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Метод комплексонометрического титрования
|
|
Комплексонометрия − раздел титриметрического анализа, основанный на реакциях комплексообразования между определяемым ионом металла (М) и титрантом (комплексоном).
Катионы металла (М), содержащие вакантные d-орбитали, реагируют с донорами электронной пары − лигандами (L), образуя координационные соединения − хелаты. Хелатообразующий лиганд с двумя донорными группами, участвующими в образовании координационной связи, называется бидентатным; лиганд с тремя донорными группами − тридентатным и т.д.
Хелатообразование всегда протекает в одну стадию, тогда как при образовании комплекса образуется несколько промежуточных соединений.
В аналитических целях реакцию комплексообразования можно использовать, только если образуется комплекс типа МL состава 1:1, в котором к каждому металла присоединен один лиганд, поскольку для таких систем характерно наибольшее изменение значения рМ вблизи точки эквивалентности.
Наиболее широкое применение в комлексонометрии нашли комплексоны. Это полиаминокарбоновые кислоты, образующие с ионами металлов комплексные соединения: этилендиаминтетрауксусная кислота (ЭДТУ) − комплексон II и ее двунатриевая соль (ЭДТА), которую называют комплексон III или трилон Б:
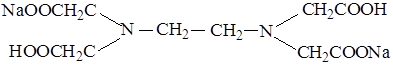
Препарат в виде белого растворимого в воде порошка является кристаллогидратом состава Nа2Н2Т · 2Н2О, где Т − анион ЭДТУ. ЭДТУ − слабая четырехосновная кислота (Н4Т), характеризующаяся четырьмя ступенями диссоциации: рКI = 2,0; рКII = 2,67; рКIII = 6,16; рКIV = 10,26. Близкие значения рКI и рКII показывают, что отщепление первых двух протонов протекает легче, чем отщепление двух оставшихся.
Данная соль относительно хорошо растворима в воде и диссоциирует, как сильный электролит:
Nа2Н2Т → 2Nа+ + Н2Т2−
Трилон Б взаимодействует со всеми катионами металлов II−IV аналитических групп. Реакции взаимодействия трилона Б с катионами металлов выражают уравнениями:
М2+ + Н2Т2−  МТ2− + 2Н+
МТ2− + 2Н+
М3+ + Н2Т2−  МТ− + 2Н+
МТ− + 2Н+
М4+ + Н2Т2−  МТ + 2Н+
МТ + 2Н+
Таким образом, ЭДТА реагирует с ионами металлов с образованием комплекса 1:1, независимо от заряда катиона. В результате реакции взаимодействия происходит замещение двух катионов водорода, поэтому fэкв(М) = ½.
Указанные равновесия зависят от рН раствора. Для обеспечения полноты протекания реакции значение рН поддерживают постоянным, применяя для этого соответствующий буферный раствор. Чем выше заряд иона металла, тем прочнее образующийся комплексонат и тем более кислая среда допускается в ходе титрования.
Водные растворы комплексона III и большинства комплексонатов металлов бесцветны. Конец титрования обычно определяют с помощью металлиндикаторов. Это органические вещества, образующие цветные комплексные соединения с определяемым катионом. Свободный индикатор и его комплекс с ионом металла окрашены неодинаково. Устойчивость комплекса индикатора с металлом должна быть высокой, но ниже устойчивости комплекса металла с комплексоном.
Раствор трилона Б готовят из высушенной при 80°С навески. Для определения точной концентрации раствора трилон Б используют стандартный раствор МgSО4, приготовленный из стандарт-титра или навеску металлического цинка, растворенную в соляной или серной кислоте.
5.1. Стандартизация раствора трилон Б
Для определения точной концентрации раствора трилон Б применяется стандартный раствор сульфата магния, приготовленный из стандарт-титра. Концентрация раствора МgSО4 = 0,01 моль/л. В качестве индикатора используется кислотный хромовый темно-синий. В основе определения лежат реакции:
1) образование комплекса катиона магния с индикатором:
рН ~ 9 Мg2+ + Нind2−  МgInd22− + 2Н+
МgInd22− + 2Н+
синий винно-красн.
2) образование более прочного комплекса катиона магния с рабочим раствором трилон Б с выделением свободной формы индикатора:
рН ~ 9 МgInd22− + Nа2Н2Т  Nа2МgТ + 2Нind2−
Nа2МgТ + 2Нind2−
винно-красн. раб.р-р бесцв. синий
Методика анализа
В колбу для титрования последовательно из бюретки отмеряется 4,0; 5,0 и 6,0 мл стандартного 0,01 М раствора МgSО4, цилиндром отмеряется 5 мл аммиачного буферного раствора, добавляется 1 капля индикатора. Объем в колбе примерно вдвое разбавляется дистиллированной водой, смывая капли растворов со стенок внутрь колбы. Полученный раствор титруют трилоном Б до перехода винно-красной окраски раствора в синюю. Расчет концентрации раствора трилона Б производится на основе закона эквивалентов:
N (МgSО4) V(МgSО4)
N (Nа2Н2Т) = ---------
V(Nа2Н2Т)
По трем значениям концентрации раствора трилон Б рассчитывается среднее значение концентрации этого раствора.
Дата публикования: 2014-11-18; Прочитано: 2167 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
