 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Классификация реакций по характеру изменения химической связи и по направлениям реакции. Гомолитический и гетеролитический разрыв химической связи
|
|
Химическая реакция – превращение одних веществ в другие – процесс, связанный с разрывом одних и образованием других, новых связей. Такой разрыв может происходить путем разделения связывающей пары электронов ковалентной связи. Каждый фрагмент (осколок) молекулы получает по одному электрону от прежней пары – это гомолитическое расщепление (гомолиз):

Частицы (атомы или группы атомов), имеющие неспаренные электроны, называют радикалами (или свободными радикалами).
Разрыв химической связи, при котором оба связывающих электрона переходят к одной из образующихся частиц, – это гетеролитическое расщепление (гетеролиз):

Величины энергий гетеролитического расщепления существенно выше, чем гомолитического (на 100 ккал/моль и больше). При гетеролизе нейтральной молекулы образуются положительный и отрицательный ионы, разделение которых требует больше энергии, чем разделение нейтральных частиц. В газовой фазе расщепление связи обычно происходит гомолитически. В ионизирующих растворителях (вода Н2О, спирты RОН, диметилформамид (СН3)2NСНО,
диметилсульфоксид (СН3)2S=О), напротив, предпочтительным оказывается гетеролиз.
Алканы. Гомологический ряд, изомерия, номенклатура. Строение метана (образование о-связи и ее пространственная направленность) и гомологов метана (представление о конфигурации углерод-углеродной цепи и свободном вращении вокруг а-связи)
Алка́ны (также насыщенные углеводороды, парафины, алифатические соединения) — ациклические углеводороды линейного или разветвлённого строения, содержащие только простые связи и образующие гомологический ряд с общей формулой CnH2n+2.
Алканы являются насыщенными углеводородами и содержат максимально возможное число атомов водорода. Каждый атом углерода в молекулах алканов находится в состоянии sp3-гибридизации — все 4 гибридные орбитали атома С равны по форме и энергии, 4 электронных облака направлены в вершины тетраэдра под углами 109°28'. За счёт одинарных связей между атомами С возможно свободное вращение вокруг углеродной связи. Тип углеродной связи — σ-связи, связи малополярны и плохо поляризуемы. Длина углеродной связи — 0,154 нм.
Простейшим представителем класса является метан (CH4).
| Название | Формула |
| Метан | СН4 |
| Этан | С2Н6 |
| Пропан | С3Н8 |
| Бутан | С4Н10 |
| Пентан | C5H12 |
| Гексан | С6Н14 |
| Гептан | С7H16 |
| Октан | C8H18 |
| Нонан | С9Н20 |
| Декан | C10H22 |
| Пентадекан | C15H32 |
| Эйкозан | С20Н42 |
| Пентакозан | C25H52 |
| Триаконтан | С30Н62 |
В молекуле метана и в других алканах, а также во всех органических молекулах по месту одинарной связи атомы углерода будут находиться в состоянии sр3-гибридизации, т. е. у атома углерода гибридизации подверглись орбитали одного s- и трех р-электронов и образовались четыре одинаковые гибридные орбитали.
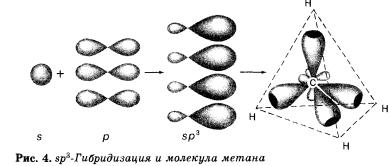
В результате перекрывания четырех гибридных sр3-орбиталей атома углерода и s орбиталей четырех атомов водорода образуется тетраэдрическая молекула метана с четырьмя одинаковыми а-связями под углом 109°28'.
Если в молекуле метана заменить один атом водорода на группу СН3, то получится молекула этана СН3—СН3.
Дата публикования: 2014-11-18; Прочитано: 1883 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
