 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Енергетичні зони в кристалах
|
|
Використовуючи рівняння Шредінгера, можна розглянути задачу про кристал, наприклад, знайти можливі значення енергії, а також відповідні енергетичні стани електронів та ядер.
Рівняння Шредінгера для кристала має такий вигляд:



 .
.
Тут  ,
,  ,... – координати електронів, а
,... – координати електронів, а  ,
,  ,... - координати ядер, m - маса електрона,
,... - координати ядер, m - маса електрона,  – маса ядра к-го атома. Перший і другий доданки відповідають сумарній кінетичній енергії всіх електронів та ядер. Наступні доданки описують кулонівську взаємодію між електронами, взаємодію між ядрами і взаємодію між електронам та ядрами. У правій частині рівняння E – повна енергія системи, яка складається із
– маса ядра к-го атома. Перший і другий доданки відповідають сумарній кінетичній енергії всіх електронів та ядер. Наступні доданки описують кулонівську взаємодію між електронами, взаємодію між ядрами і взаємодію між електронам та ядрами. У правій частині рівняння E – повна енергія системи, яка складається із
енергії електронів і ядер.
Тепер будемо повільно зближати атоми ґратки, не порушуючи її симетрію. На рис. 355 наведена картина, яка відповідає такому зближенню. З цього рисунка видно, що потенціальні криві, які відділяють сусідні атоми (показані пунктиром), частково накладаються одна на одну і дають результуючі криві, які проходять нижче нульового рівня 00 (на рисунку вони показані суцільними лініями).
Отже, зближення атомів зменшує товщину потенціального бар’єру до значення порядку a і зменшує його висоту. Для електронів рівня 1s висота бар’єра стає  , для електронів 2s -
, для електронів 2s -  , для електронів 2p -
, для електронів 2p -  . Для електронів рівня 3s висота бар’єра виявляється нижчою від початкового положення рівня 3s в атомі натрію. Тому валентні електрони цього рівня отримують можливість практично без перешкод переходити від одного ат ома до
. Для електронів рівня 3s висота бар’єра виявляється нижчою від початкового положення рівня 3s в атомі натрію. Тому валентні електрони цього рівня отримують можливість практично без перешкод переходити від одного ат ома до іншого. Про це свідчить і характер електронних хмар валентних електронів, вони перекриваються настільки сильно, що створюють результуючу хмару рівномірної густини (рис. 355). Це відповідає стану
повної їх колективізації в ґратці. Такі колективні електрони називаються вільними, а їх сукупність – електронним газом.
Внаслідок різкого зменшення товщини і висоти потенціального бар’єра при зближенні атомів можливість переміщення в кристалі отримують не лише валентні електрони, але й електрони, що розміщені на інших рівнях атомів. Переміщення відбувається шляхом тунельного переходу електронів через бар’єри, що відокремлюють сусідні атоми.
Найбільший вплив поле ґратки чинить на зовнішні валентні електрони атомів. Тому стани цих електронів в кристалі відчувають найбільші зміни, а енергетичні зони, які утворені з енергетичних рівнів цих електронів, виявляються найбільш широкими.
Внутрішні ж електрони, які сильно зв’язані з ядром, відчувають лише незначні збурення від інших атомів, внаслідок чого їх енергетичні рівні в кристалі залишаються практично такими ж вузькими, як і в ізольованих атомах. На рис. 356 наведена схематична картина утворення енергетичних зон в кристалі із дискретних атомних рівнів.
Отже, кожному енергетичному рівню ізольованого атома в кристалі відповідає зона дозволених рівнів: рівню 1s – зона 1s, рівню 2p – зона 2p і т.д..
Зони дозволених енергій розділені областями заборонених енергій – забороненими зонами. Із збільшенням енергій електрона в атомі ширина дозволених зон збільшується, ширина заборонених – зменшується.
Дозволені енергетичні зони в твердому тілі можуть бути різним чином заповнені електронами. У граничних випадках вони можуть бути цілком заповнені або цілком вільні. Електрони в твердих тілах можуть переходити з однієї дозволеної зони в іншу. Для переходу електрона з
нижньої зони в сусідню верхню зону необхідно затратити енергію, що дорівнює ширині забороненої зони, яка розміщена між ними.
Для внутрішніх переходів електронів в межах зони необхідна дуже мала
енергія, тому, що відстані між сусідніми енергетичними рівнями в зоні дорівнює приблизно 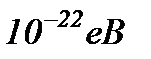 . Наприклад, для цього достатньо енергії
. Наприклад, для цього достатньо енергії  , що отримує електрон в металі під дією електричного поля на довжині вільного пробігу при звичайних різницях потенціалів. Під дією спеціального збудження електронам може бути надана енергія, достатня як для внутрішньозонних, так і для міжзонних переходів.
, що отримує електрон в металі під дією електричного поля на довжині вільного пробігу при звичайних різницях потенціалів. Під дією спеціального збудження електронам може бути надана енергія, достатня як для внутрішньозонних, так і для міжзонних переходів.
Дата публикования: 2014-11-04; Прочитано: 1048 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
