 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Реакции ионного обмена
|
|
В разбавленных растворах электролитов (кислот, оснований, солей) химические реакции протекают обычно при участии ионов. При этом все элементы реагентов могут сохранять свои степени окисления (обменные реакции) или изменять их (окислительно‑восстановительные реакции). Примеры, приводимые далее, относятся к обменным реакциям (о протекании окислительно‑восстановительных реакций см. разд. 14).
В соответствии с правилом Бертолле, ионные реакции протекают практически необратимо, если образуются твердые малорастворимые вещества (они выпадают в осадок), легколетучие вещества (они выделяются в виде газов) или растворимые вещества – слабые электролиты (в том числе и вода). Ионные реакции изображаются системой уравнений – молекулярным, полным и кратким ионным. Ниже полные ионные уравнения опущены (читателю предлагается составить их самому).
При написании уравнений ионных реакций надо обязательно руководствоваться таблицей растворимости (см. табл. 8).
Примеры реакций с выпадением осадков:
а)
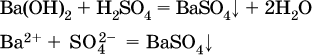
б)
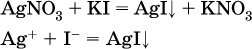
в)

г)
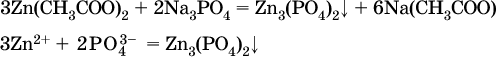
Внимание! Указанные в таблице растворимости (см. табл. 15) малорастворимые («м») и практически нерастворимые («н») соли выпадают в осадок именно в том виде, как они представлены в таблице (СаF2↓, PbI2↓, Ag2SO4↓, AlPO4↓ и т. д.).
В табл. 15 не указаны карбонаты – средние соли с анионом CO32‑. Следует иметь в виду, что:
1) К2СO3, (NH4)2CO3 и Na2CO3 растворимы в воде;
2) Ag2CO3, ВаСO3 и СаСO3 практически нерастворимы в воде и выпадают в осадок как таковые, например:
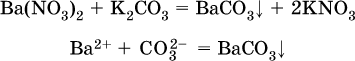
3) соли остальных катионов, такие как MgCO3, CuCO3, FeCO3, ZnCO3 и другие, хотя и нерастворимы в воде, но не осаждаются из водного раствора при проведении ионных реакций (т. е. их нельзя получить этим способом).
Например, карбонат железа (II) FeCO3, полученный «сухим путем» или взятый в виде минерала сидерит, при внесении в воду осаждается без видимого взаимодействия. Однако при попытке его получения по обменной реакции в растворе между FeSO4 и К2СO3 выпадает осадок основной соли (приведен условный состав, на практике состав более сложный) и выделяется углекислый газ:
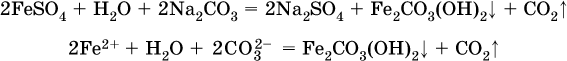
Аналогично FeCO3, сульфид хрома (III) Cr2S3 (нерастворимый в воде) не осаждается из раствора:
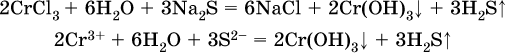
В табл. 15 не указаны также соли, которые разлагаются водой – сульфид алюминия Al2S3 (а также BeS) и ацетат хрома (III) Cr(СН3СОО)3:
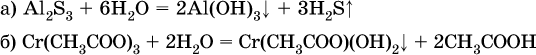
Следовательно, эти соли также нельзя получить по обменной реакции в растворе:
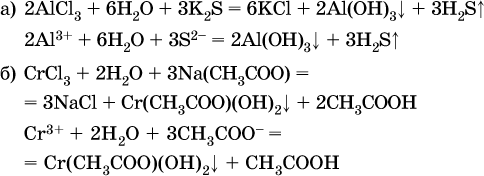
(в последней реакции состав осадка более сложный; подробнее такие реакции изучают в высшей школе).
Примеры реакций с выделением газов:
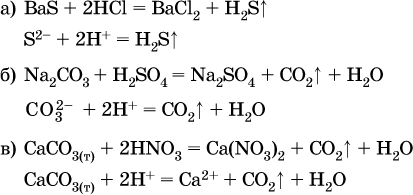
Примеры реакций с образованием слабых электролитов:
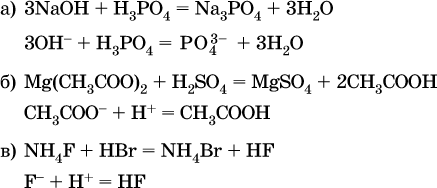
Если реагенты и продукты обменной реакции не являются сильными электролитами, ионный вид уравнения отсутствует, например:
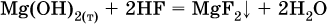
Дата публикования: 2014-11-04; Прочитано: 1366 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
