 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Водород. Водород – первый элемент Периодической системы (1‑й период, порядковый номер 1)
|
|
Водород – первый элемент Периодической системы (1‑й период, порядковый номер 1). Не имеет полной аналогии с остальными химическими элементами и не принадлежит ни к какой группе (в таблицах условно помещается в IA– и/или в VIIA‑группу).
Атом водорода наименьший по размерам и самый легкий среди атомов всех элементов. Электронная формула атома 1s1, характерные степени окисления 0, +I и реже – I. Состояние HI считается устойчивым (соединения с H‑I – сильные восстановители).
Шкала степеней окисления водорода:
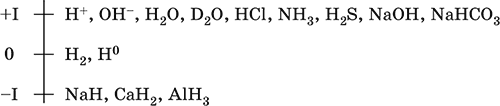
По электроотрицательности (2,10) водород занимает промежуточное положение между типичными металлами и типичными неметаллами. Проявляет амфотерные свойства – металлические и неметаллические. Входит в состав катионов (катионы оксония Н3O+ и аммония NH4+, аквакатионы металлов) и многочисленных анионов – кислых кислотных остатков (HS‑, HCO3‑ и др.).
Природный водород содержит изотоп 1Н – протий с примесью стабильного изотопа 2H(D) – дейтерия и следами радиоактивного изотопа 3Н(Т) – трития (на Земле всего 2 кг трития). В химии символом Н в формулах веществ обозначается содержащаяся в них природная смесь изотопов с преобладанием изотопа протий, а сами вещества рассматриваются как почти изотопночистые соединения протия.
Водород – наиболее распространенный элемент в космосе (Солнце, большие планеты Юпитер и Сатурн, звезды, межзвездная среда, туманности); в состав космической материи входит 63 % Н, 36 % Не и 1 % всех остальных элементов.
В природе – третий по химической распространенности элемент (после О и Si), основа гидросферы. Встречается в химически связанном виде (вода, живые организмы, нефть, природный уголь, минералы), содержится в верхних слоях атмосферы.
Водород Н2. Простое вещество. Бесцветный газ без запаха и вкуса. Молекула содержит ковалентную σ‑связь Н – Н. Очень легкий, термически устойчивый до 2000 °C. Весьма мало растворим в воде. Хемосорбируется металлами Fe, Ni, Pd, Pt, где находится в атомном состоянии.
Водород Н2 может проявлять в одних условиях восстановительные свойства (чаще), в других – окислительные свойства (реже):
восстановитель Н20 – 2е‑ = 2НI
окислитель Н20 + 2е‑ = 2Н‑I
Сильный восстановитель при высоких температурах, водород реагирует с неметаллами и оксидами малоактивных металлов, выполняет роль окислителя в реакциях с типичными металлами:
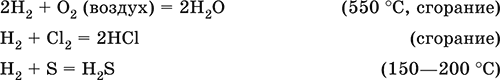

Очень высокой восстановительной способностью обладает атомарный водород Н0 (водород in statu nascendi, лат., – в момент возникновения), который получают непосредственно в зоне проводимой реакции (время жизни Н0 0,5 с); например, гранулы магния вносят в подкисленный раствор переманганата калия, протекают реакции:
а) образование атомарного водорода
Mg + 2Н+ = Mg2+ + 2Н0
б) восстановление перманганат‑иона атомарным водородом
5Н0 + 3H+ + MnO4‑ = Mn2+ + 4Н2O
Другой пример – восстановление нитробензола в анилин (реакция Зинина):
а) Fe + 2Н+ = Fe2+ + 2Н0
б) C6H5NO2 + 6Н0 = C6H5NH2 + 2Н2O
Получить атомарный водород можно также пропусканием водорода Н2 над никелевым катализатором.
Атомарный водород легко восстанавливает при комнатной температуре весьма устойчивые соединения, например KNO3 и O2:
2Н0 (Zn, разб. HCl) + KNO3 = KNO2 + H2O
2H0 (Zn, разб. HCl) + O2 = Н2O2
Аналогично протекают реакции при использовании амфигенов (Zn, Al) в щелочной среде:
а) Zn + 2OH‑ + 2H2O = [Zn(OH)4]2‑ + 2Н0
б) 8Н0 + KNO3 = NH3↑ + КОН + 2Н2O (кипячение)
Качественная реакция – сгорание собранного в пробирку водорода с «хлопком» («гремучая» смесь с воздухом при содержании Н2 4–74 % по объему).
Применяется водород как восстановитель и гидрирующий агент в синтезе технически важных продуктов (редкие металлы, NH3, НCl, органические вещества).
Вода Н2O. Бинарное соединение. Бесцветная жидкость (слой более 5 м толщиной окрашен в голубой цвет), без вкуса и запаха. Молекула имеет строение дважды незавершенного тетраэдра [:: ОН2] (sр3‑гибридизация). Летучее вещество, термически устойчивое до 1000 °C.
В обычных условиях полярные молекулы воды образуют между собой водородные связи. Это обусловливает аномалию температур плавления и кипения воды – они значительно выше, чем у ее химических аналогов (H2S и других). Затвердевание воды в лед сопровождается увеличением объема на 9 %, т. е. лед легче жидкой воды (вторая аномалия воды). Наибольшую плотность вода имеет не при 0 °C, а при 4 °C (третья аномалия воды). Твердая вода (лед) легко возгоняется.
Природная вода по изотопному составу водорода в основном 1Н2O с примесью 1Н2НО и 2Н2O, по изотопному составу кислорода в основном Н216O с примесью Н218O и Н217O. В малой степени подвергается диссоциации до Н+, или, точнее, до Н3O+, и ОН; очень слабый электролит. Катион оксония Н3O+ имеет строение незавершенного тетраэдра [: O(Н)3] (sр3‑гибридизация). Образует кристаллогидраты со многими солями, аквакомплексы – с катионами металлов. Реагирует с металлами, неметаллами, оксидами. Вызывает электролитическую диссоциацию кислот, оснований и солей, гидролизует многие бинарные соединения и соли. Подвергается электролизу в присутствии сильных электролитов. Почти универсальный жидкий растворитель неорганических веществ.
Для химических целей природную воду очищают перегонкой (дистиллированная вода), для промышленных целей умягчают, устраняя «временную» и «постоянную» жесткость, или полностью обессоливают, пропуская через иониты в кислотной Н+‑форме и щелочной ОН‑ – форме (ионы солей осаждаются на ионитах, а ионы Н+ и ОН‑ переходят в воду и взаимно нейтрализуются). Питьевую воду обеззараживают хлорированием (старый способ) или озонированием (современный, но дорогой способ; озон не только окисляет вредные примеси подобно хлору, но и увеличивает содержание растворенного кислорода).
Уравнения важнейших реакций:
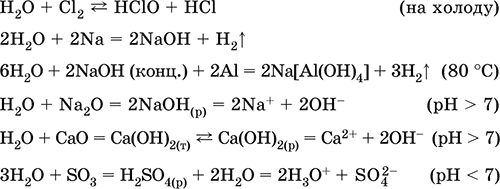
Примеры гидролиза бинарных соединений:
6H2O + Al2S3 = 2Al(ОН)3↓ + 3H2S↑
2H2O + SF4 = SO2↑ + 4HF↑ (40–60 °C)
6H2O + Mg3N2 = 3Mg(OH)2↓ + 2NH3↑ (кипячение)
2H2O + CaC2 = Ca(OH)2↓ + C2H2↑
Вода – окислитель за счет HI:
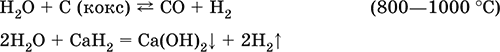
Электролиз воды:
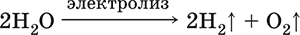
Электропроводность чистой (дистиллированной) воды весьма мала, поэтому электролиз проводят в присутствии сильных электролитов.
а) в нейтральном растворе (электролит Na2SO4)
катод 2H2O + 2е‑ = H2↑ + 2OH
анод 2Н2O – 4е‑ = O2↑ + 4H+
раствор ОН‑ + Н+ = Н2O
б) в кислом растворе (электролит H2SO4)
катод 2Н+ + 2е‑ = Н2↑
анод 2Н2O – 4е‑ = O2↑ + 4Н+
в) в щелочном растворе (электролит NaOH)
катод 2Н2O + 2е‑ = Н2↑ + 2OН‑
анод 4OН‑ – 4е‑ = O2↑ + 2Н2O
Один из методов обнаружения воды основан на переходе во влажной атмосфере белого сульфата меди(II) CuSO4 в голубой медный купорос CuSO4 5Н2O.
Известна изотопная разновидность воды – тяжелая вода D2O (2Н2O); в природных водах массовое отношение D2O: Н2O = 1: 6000.
Плотность, температуры плавления и кипения тяжелой воды выше, чем у обыкновенной. Растворимость большинства веществ в тяжелой воде значительно меньше, чем в обычной воде. Она ядовита, так как замедляет биологические процессы в живых организмах. Тяжелая вода накапливается в остатке электролита при многоразовом электролизе воды. Используется как теплоноситель и замедлитель нейтронов в ядерных реакторах.
Гидрид кальция СаН2. Бинарное соединение. Белый, имеет ионное строение Са2+(Н‑)2. При плавлении разлагается. Чувствителен к кислороду воздуха. Сильный восстановитель, реагирует с водой, кислотами. Применяется как твердый источник водорода (1 кг СаН2 дает 1000 л Н2), осушитель газов и жидкостей, аналитический реагент для количественного определения воды в кристаллогидратах.
Уравнения важнейших реакций:
СаН2 = Н2 + Са (особо чистый) (выше 1000 °C)
СаН2 + 2Н2O = Са(ОН)2 + 2Н2↑
СаН2 + 2НCl (разб.) = СаCl2 + 2Н2↑
СаН2 + O2 = Н2O + СаО (особо чистый) (300–400 °C)
ЗСаН2 + N2 = ЗН2 + Ca3N2 (выше 1000 °C)
ЗСаН2 + 2КClO3 = 2КCl + ЗСаО + ЗН2O (450–550 °C)
СаН2 + H2S = CaS + 2Н2 (500–600 °C)
Получение: обработка нагретого кальция водородом.
Дата публикования: 2014-11-04; Прочитано: 1775 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
