 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Внутрішня енергія газу
|
|
Внутрішня енергія реального газу є сумою кінетичної енергії теплового руху молекул і потенційної енергії міжмолекулярної взаємодії молекул. Розглянемо 1 моль газу. Кінетична енергія теплового руху, якщо CV не залежить від температури (не враховуються коливальні ступені свободи), дорівнює СVТ. Потенціальна енергія реального газу обумовлена силами притягання і рівна роботі, яку треба витратити проти сил притягання для того, щоб розвести молекули на нескінченно велику
відстань, коли вони не взаємодіють. Оскільки тиск за рахунок тяжіння між молекулами реального газу – це  , потенціальна енергія
, потенціальна енергія  де нижня межа інтеграції обирається з умови рівності нулю при ній потенціальної енергії. Таким чином, внутрішня енергія 1 моля реального газу
де нижня межа інтеграції обирається з умови рівності нулю при ній потенціальної енергії. Таким чином, внутрішня енергія 1 моля реального газу  росте з підвищенням температури і збільшенням об'єму. Звичайно, внутрішня енергія кількості речовини ν буде в ν раз більше. Якщо газ розширюється без теплообміну з навколишнім середовищем (адіабатний процес, тобто dQ = 0) і не здійснює зовнішньої роботи (δA = 0), то на підставі першого закону термодинаміки одержимо, що
росте з підвищенням температури і збільшенням об'єму. Звичайно, внутрішня енергія кількості речовини ν буде в ν раз більше. Якщо газ розширюється без теплообміну з навколишнім середовищем (адіабатний процес, тобто dQ = 0) і не здійснює зовнішньої роботи (δA = 0), то на підставі першого закону термодинаміки одержимо, що 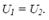 Отже при адіабатному розширенні без здійснення зовнішньої роботи внутрішня енергія газу не змінюється. Ця рівність для ідеального газу означала б незмінність температури при адіабатному розширенні. У випадку реального газу (для 1 моля)
Отже при адіабатному розширенні без здійснення зовнішньої роботи внутрішня енергія газу не змінюється. Ця рівність для ідеального газу означала б незмінність температури при адіабатному розширенні. У випадку реального газу (для 1 моля)  тому
тому  Оскільки V2 > V1, то Т1 > Т2, тобто реальний газ при адіабатному розширенні без здійснення роботи охолоджується.
Оскільки V2 > V1, то Т1 > Т2, тобто реальний газ при адіабатному розширенні без здійснення роботи охолоджується.
Дата публикования: 2015-11-01; Прочитано: 2127 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
