 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Решение ур-я Шредингера для атома водорода. Полная система квантовых чисел. Принцип Паули
|
|
Потенциальная энергия взаимодействия электрона с ядром, обладающим зарядом Ze (для атома водорода Z = 1),
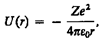 (223.1)
(223.1)
где r — расстояние между электроном и ядром. Графически функция U (r) изображена жирной кривой на рис. 302. U (r) с уменьшением r (при приближении электрона к ядру) неограниченно убывает.
Состояние электрона в атоме водорода описывается волновой функцией y, удовлетворяющей стационарному уравнению Шредингера (217.5), учитывающему значение (223.1):
 (223.2)
(223.2)
где т — масса электрона, Е — полная энергия электрона в атоме. Так как поле, в котором движется электрон, является центрально-симметричным, то для решения уравнения (223.2) обычно используют сферическую систему координат: r, q, j. Не вдаваясь в математическое решение этой задачи, ограничимся рассмотрением важнейших результатов, которые из него следуют, пояснив их физический смысл.
1. Энергия. В теории дифференциальных уравнений доказывается, что уравнения типа (223.2) имеют решения, удовлетворяющие требованиям однозначности, конечности и непрерывности волновой функции y, только при собственных значениях энергии
 (223.3)
(223.3)
т. е. для дискретного набора отрицательных значений энергии.
Энергия ионизации атома водорода равна

2. Квантовые числа. В квантовой механике доказывается, что уравнению Шредингера (223.2) удовлетворяют собственные функции  , определяемые тремя квантовыми числами: главным п, орбитальным l и магнитным тl.
, определяемые тремя квантовыми числами: главным п, орбитальным l и магнитным тl.
Главное квантовое число n, согласно (223.3), определяет энергетические уровни электрона в атоме и может принимать любые целочисленные значения начиная с единицы:

Из решения уравнения Шредингера вытекает, что момент импульса (механический орбитальный момент) электрона квантуется, т. е. не может быть произвольным, а принимает дискретные значения, определяемые формулой
 (223.4)
(223.4)
где l — орбитальное квантовое число, которое при заданном n принимает значения
 (223.5)
(223.5)
т. е. всего n значений, и определяет момент импульса электрона в атоме.
Из решения уравнений Шредингера следует также, что вектор L l момента импульсаэлектрона может иметь лишь такие ориентации в пространстве, при которых его проекция Llx на направление z внешнего магнитного поля принимает квантованныезначения, кратные ћ:
 (223.6)
(223.6)
где тl— магнитное квантовое число, которое при заданном l может принимать значения
 (223.7)
(223.7)
т. е. всего 2 l +1 значений. Таким образом, магнитное квантовое число ml определяет проекцию момента импульса электрона на заданное направление, причем вектор момента импульса электрона в атоме может иметь в пространстве 2 l +1 ориентации.
Если тождественные частицы имеют одинаковые квантовые числа, то их волновая функция симметрична относительно перестановки частиц. Отсюда следует, что два одинаковых фермиона, входящих в одну систему, не могут находиться в одинаковых состояниях, так как для фермионов волновая функция должна быть антисимметричной. Обобщая опытные данные, В. Паули сформулировал принцип, согласно которому системы фермионов встречаются в природе только в состояниях, описываемых антисимметричными волновыми функциями (квантово-механическая формулировка принципа Паули).
Из этого положения вытекает более простая формулировка принципа Паули, которая и была введена им в квантовую теорию (1925) еще до построения квантовой механики: в системе одинаковых фермионов любые два из них не могут одновременно находиться в одном и том же состоянии. Отметим, что число однотипных бозонов, находящихся в одном и том же состоянии, не лимитируется.
Напомним, что состояние электрона в атоме однозначно определяется набором четырех квантовых чисел:

Распределение электронов в атоме подчиняется принципу Паули, который может быть использован в его простейшей формулировке: в одном и том же атоме не может быть более одного электрона с одинаковым набором четырех квантовых чисел п, l, ml и тs т. е.

где Z (п, l, ml, тs) — число электронов, находящихся в квантовом состоянии, описываемом набором четырех квантовых чисел: п, l, ml, тs. Таким образом, принцип Паули утверждает, что два электрона, связанные в одном и том же атоме, различаются значениями по крайней мере одного квантового числа.
Согласно формуле (223.8), данному n соответствует n 2 различных состояний, отличающихся значениями l и ml. Квантовое число тs может принимать лишь двазначения (± ½). Поэтому максимальное число электронов, находящихся в состояниях, определяемых данным главным квантовым числом, равно

Совокупность электронов в многоэлектронном атоме, имеющих одно и то же главное квантовое число n, называют электронной оболочкой. В каждой из оболочекэлектроны распределяются по подоболочкам, соответствующим данному l. Поскольку орбитальное квантовое число принимает значения от 0 до n –1, число подоболочек равно порядковому номеру n оболочки. Количество электронов в подоболочке определяется магнитным и магнитным спиновым квантовыми числами: максимальное число электронов в подоболочкес данным l равно 2(2 l +1). Обозначения оболочек, а также распределение электронов по оболочкам и подоболочкам представлены в табл. 6.
Таблица 6

Дата публикования: 2015-11-01; Прочитано: 1310 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
