 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Теоретические пояснения. При образовании растворов характер взаимодействия компонентов определяется их химической природой, что затрудняет выявление общих закономерностей
|
|
При образовании растворов характер взаимодействия компонентов определяется их химической природой, что затрудняет выявление общих закономерностей. Поэтому удобно прибегнуть к некоторой идеализированной модели раствора. Такой раствор, образование которого не связано с тепловым эффектом и с изменением объема называют идеальным раствором.
Хотя большинство растворов и не обладает в полной мере свойствами идеальных, однако свойства многих из них могут быть описаны при помощи этой модели. Наиболее подходящими в этом плане являются разбавленные растворы, в которых содержание растворенного вещества очень мало по сравнению с содержанием растворителя.
Рассмотрим свойства разбавленных растворов, которые зависят от числа частиц растворенного вещества и от количества растворителя, но практически не зависят от природы растворенных частиц (коллигативные свойства).
К таким свойствам относятся: понижение давления насыщенного пара растворителя над раствором, повышение температуры кипения, понижение температуры замерзания раствора по сравнению с чистым растворителем, осмотическое давление.
Согласно закону Рауля, относительное понижение давления насыщенного пара над раствором равно мольной доле растворенного нелетучего вещества:

Повышение температуры кипения и понижение температуры замерзания растворов по сравнению с чистым растворителем, по следствию из закона Рауля прямопропорциональны моляльной концентрации растворенного вещества:

где 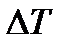 - изменение температуры,
- изменение температуры, 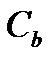 - моляльная концентрация (моль/кг),
- моляльная концентрация (моль/кг), 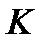 - коэффициент пропорциональности, в случае повышения температуры кипения называется эбулиоскопической константой, а для понижения температуры замерзания – криоскопической. Эти константы, численно различные для одного и того же растворителя, характеризуют повышение температуры кипения и понижение температуры замерзания одномоляльного раствора, т.е. при растворении 1 моль электролита в 1000 г растворителя. Поэтому их часто называют моляльным повышением температуры кипения и понижением температуры замерзания раствора. Криоскопические и эбулиоскопические константы не зависят от природы растворенного вещества, а лишь зависят от природы растворителя и характеризуются размерность
- коэффициент пропорциональности, в случае повышения температуры кипения называется эбулиоскопической константой, а для понижения температуры замерзания – криоскопической. Эти константы, численно различные для одного и того же растворителя, характеризуют повышение температуры кипения и понижение температуры замерзания одномоляльного раствора, т.е. при растворении 1 моль электролита в 1000 г растворителя. Поэтому их часто называют моляльным повышением температуры кипения и понижением температуры замерзания раствора. Криоскопические и эбулиоскопические константы не зависят от природы растворенного вещества, а лишь зависят от природы растворителя и характеризуются размерность 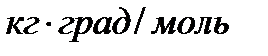 . Ниже приведены криоскопические
. Ниже приведены криоскопические 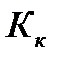 и эбулиоскопические
и эбулиоскопические 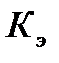 константы для некоторых растворителей:
константы для некоторых растворителей:
| Растворитель | Температура, 0С | Константа, 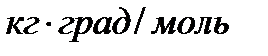
| ||
| Кипения | Плавления | 
| 
| |
| Н2О | 0,52 | 1,86 | ||
| С6Н6 | 80,1 | 5,5 | 2,53 | 5,12 |
| ССI4 | 76,5 | -22 | 5,03 | 30,0 |
| СНСI3 | 61,7 | -63,5 | 3,63 | 4,7 |
Криоскопия и эбулиоскопия – методы определения молекулярных масс растворенных веществ. Эти методы позволяют определить молекулярную массу не диссоциирующих при растворении веществ по понижению температуры замерзания и по повышению температуры кипения растворов известной концентрации:
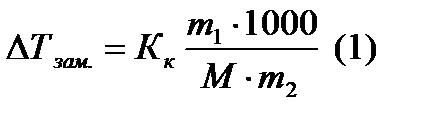
где  - масса растворенного вещества в граммах,
- масса растворенного вещества в граммах, 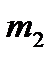 - масса растворителя в граммах,
- масса растворителя в граммах,  - молярная масса растворенного вещества в г/моль, 1000- коэффициент пересчета от граммов растворителя к килограммам. Из (1) молярная масса неэлектролита выразится как:
- молярная масса растворенного вещества в г/моль, 1000- коэффициент пересчета от граммов растворителя к килограммам. Из (1) молярная масса неэлектролита выразится как:
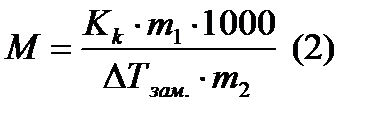
Дата публикования: 2015-10-09; Прочитано: 294 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
