 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Гетерогенные процессы. Скорость гетерогенных процессов. Коэффициент скорости процесса
|
|
Большинство химико-технологических процессов относятся к гетерогенным; при этом огромное разнообразие гетерогенных процессов затрудняет их классификацию.
Механизм гетерогенных процессов сложнее гомогенных, так как реагирующие вещества находятся в разных фазах и подвод их к поверхности раздела фаз, где происходит химическое взаимодействие, а также массообмен между фазами осуществляются в результате молекулярной и конвективной диффузии, которые накладываются на основной химический процесс. Усложнение вносят также процессы теплообмена и процессы, обусловленные особенностями гидродинамики потока. Только с учетом всех факторов, влияющих на технологический процесс, можно установить условия, обеспечивающие максимальную его интенсивность, и управлять этим процессом.
Примером гетерогенного процесса может служить процесс горения угля, который складывается из пяти стадий: внешняя диффузия 02 (через пограничный газовый слой); внутренняя диффузия 02 (через слой золы); химическая реакция; внутренняя диффузия СОг (через слой золы); внешняя диффузия СО2 (через пограничный слой газа).
Горение угля сравнительно простой пример; на практике обычно протекают более сложные процессы. Однако в любом гетерогенном химическом процессе можно выделить три основных одновременно протекающих процесса:
1) диффузия реагентов к границе раздела фаз;
2) химическая реакция;
3) диффузия продуктов реакции из зоны реакции.
Скорость гетерогенных процессов
Для установления оптимальных параметров гетерогенных процессов и их аппаратурного оформления и проектирования необходимо прежде всего изучить статику (т. е. равновесие) и кинетику (т. е. скорость) этих процессов.
Равновесие в гетерогенных системах зависит от температуры, давления и концентрации как исходных реагентов, так и продуктов реакции, скорость же взаимодействия реагентов, находящихся в разных фазах, зависит не только от скорости химической реакции, но и от многих других факторов (как любой процесс, протекающий на макроуровне). Поэтому в общем виде скорость гетерогенного процесса выражается следующим уравнением:
r = KF ∆С
где r - скорость гетерогенного процесса;
К - коэффициент скорости процесса;
F - поверхность контакта фаз;
∆С - движущая сила процесса.
Коэффициент скорости процесса
Коэффициент включает в себя многие факторы, влияющие на скорость гетерогенного процесса. В большинстве практических случаев влияние этих факторов неодинаково. Так, например, химический процесс обычно состоит из нескольких стадий, а его общая скорость определяется скоростью наиболее медленной (лимитирующей) стадии. Поэтому для интенсификации процесса необходимо прежде всего определить, какая из стадий является наиболее медленной, и ускорить ее. Такими наиболее медленными стадиями, каждая из которых может тормозить весь процесс, являются:
1 химическая реакция;
2 диффузия;
3 одновременно химическая реакция и диффузия.
В первом случае, скорость диффузии велика по сравнению со скоростью химической реакции; тогда говорят, что процесс протекает в кинетической области. Во втором случае, скорость химической реакции значительно больше скорости диффузии - процесс протекает в диффузионной области (во внешне или внутридиффузионной). В третьем случае, скорости отдельных стадий соизмеримы, тогда говорят, что процесс протекает в переходной (смешанной) области.
После установления лимитирующей стадии процесса принимают меры, обеспечивающие повышение скорости этой стадии. Так, если процесс протекает в кинетической области, создают условия, ускоряющие химическую реакцию; если процесс протекает в диффузионной области, то ускоряют процесс диффузии; если же процесс протекает в переходной области, то создают условия, повышающие и скорость химической реакции, и скорость диффузии. Для установления лимитирующей стадии процесса существует несколько приемов. Рассмотрим наиболее важные из них.
Температура оказывает сильное влияние на скорость химических реакций. Так при увеличении температуры на 10°С скорость химической реакции в некоторых случаях возрастает в 2—3 раза.
Скорость диффузии газов зависит от температуры в значительно меньшей степени, приближенно эта зависимость выражается уравнением:
D = аТ2
где D - коэффициент диффузии;
а - постоянный коэффициент.
Из уравнения следует, что при повышении температуры на 100С скорость диффузии увеличивается всего на 3-5%. Это разное влияние температуры используют для определения лимитирующей стадии процесса.
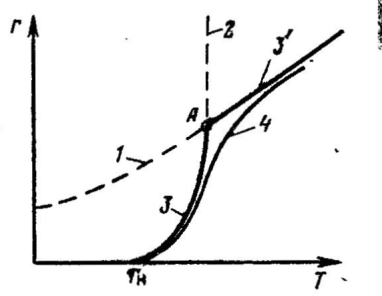
На рисунке кривая 1 отражает температурную зависимость скорости диффузии исходного реагента в зону реакции (rф). Кривая 2 отражает функциональную зависимость скорости химической реакции от температуры в соответствии с уравнением Аррениуса (rх.р.). Общая скорость отражена на рисунке двумя отрезками кривых 3 и 3'. Кривая 3 берет свое начало при температуре Тн, когда процесс химического взаимодействия начинает протекать с заметной скоростью. Затем наблюдается резкий подъем кривой. В точке А, где пересекаются кривые 1 и2, скорость химической реакции и скорость диффузии равны rф = rх.р. = r. В дальнейшем величина r равна rф. Общая скорость процесса не может превышать самую низкую составляющую ее скорость rф ≥ r ≤ rх.р. Кривая 4 построена по опытным данным. Лимитирующая стадия гетерогенного процесса может быть установлена опытным путем. Так, если опыт показывает, что повышение температуры оказывает сильное влияние на скорость процесса, то процесс протекает в кинетической области (рис. III.3, область1). Если при дальнейшем повышении температуры ее влияние на скорость общего процесса уменьшается, значит процесс перешел в переходную область (рис. III.3, область2). Если же далее при повышении температуры общая скорость процесса практически не изменяется, значит процесс протекает в диффузионной области (рис. III. 3, область3).
Дата публикования: 2015-10-09; Прочитано: 4202 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
