 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Определенпе количества теплоты
|
|
Количество теплоты в термодинамическом процессе определяется двумя способами:
- с использованием энтропии путем интегрирования уравнения 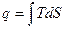 ;
;
- с использованием понятия теплоемкости.
Удельная теплоемкость – количество теплоты, которое должно быть подведено или отведено от единицы вещества (1 кг; 1 м3; 1 kмоль) для изменения температуры на 1k.
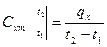
Определяемая таким образом теплоемкость называется средней в интервале температур t1 , t2 .
Параметр x характеризует вид термодинамического процесса. Истинная теплоемкость – это предел следующего отношения:
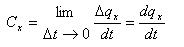
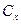 - истинная теплоемкость
- истинная теплоемкость
Теплоемкость может изменяться от  до
до 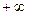 и ее значение зависит от вида процесса.
и ее значение зависит от вида процесса.
В зависимости от выбора единицы количества вещества различают теплоемкости:
- массовую 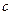
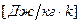
- объемную 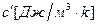
- мольную 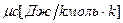
Связь между этими теплоемкостями при нормальных условиях имеет такой вид:
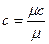 ;
; 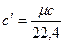
В общем случае:
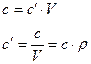
В зависимости от вида термодинамического процесса различают теплоемкость в процессе при постоянном объеме (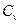 ) и теплоемкость в процессе при постоянном давлении (
) и теплоемкость в процессе при постоянном давлении (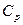 ).
).
Связь между этими теплоемкостями для идеального газа устанавливается уравнением Майера:
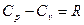 (1)
(1)
Для реальных газов всегда 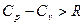 .
.
В термодинамических расчетах широко используется величина равная отношению
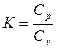 - где К - показатель адиабата или коэффициент Пуассона. (2)
- где К - показатель адиабата или коэффициент Пуассона. (2)
Для идеальных газов 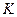 не зависит от параметров состояния и химической природы вещества, а определяется только атомностью (количеством атомов в молекуле) и равен
не зависит от параметров состояния и химической природы вещества, а определяется только атомностью (количеством атомов в молекуле) и равен
K=1,67 - для одноатомных газов (инертные газы);
K=1,4 - для двухатомных газов (H, O2, CO);
K=1,3 - для трехатомных и многоатомных газов (CO2, CH4).
Решая совместно уравнения (1) и (2), можно получить такие соотношения:
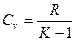 ;
; 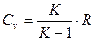
Для определения количества теплоты подведенного или отведенного в термодинамическом процессе можно использовать следующие соотношения:
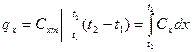
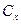 ,
, 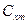 - для реальных газов зависит от параметров состояния.
- для реальных газов зависит от параметров состояния.
В общем случае зависимость теплоемкости от температуры выражается в виде полинома
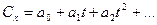
Для упрощения расчетов приведенные выше формулы могут быть преобразованы
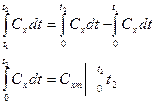

Величины средней теплоемкости для различных газах в интервалах температур от 0 до t с шагом от 10o до 50o приведены в справочной литературе.
Тема: ПЕРВЫЙ ЗАКОН ЗАКОН ТЕРМОДИНАМИКИ
Этот закон является частным случаем всеобщего закона сохранения и превращения энергии, в соответствии с которым энергия не исчезает и не появляется, а переходит из одного вида в другой в эквивалентных количествах.
Общая запись энергии любой термодинамической системы определяется:
 ,
,
где Екин . и Епот. –кинетическая и потенциальная энергии системы как целого.
Если система неподвижна, то 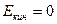 , а зачастую потенциальной можно пренебречь (
, а зачастую потенциальной можно пренебречь (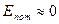 ), тогда
), тогда
E=U,
где U – внутренняя энергия системы.
Рассмотрим этот закон для изолированной системы, т.е. которая не взаимодействует с окружающей средой, и открытой системы, которая обменивается с окружающей средой теплотой и работой.
Для изолированной системы уравнение 1-го закона термодинамики имеет вид:
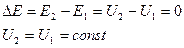
Для системы, находящейся во взаимодействии с окружающей средой, общий запас энергии будет изменяться в процессах на величину энергии взаимодействия системы с окружающей средой.
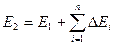
Обычно взаимодействие системы с окружающей средой проявляется в виде обмена теплотой и работой.
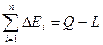
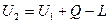 ;
; 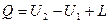
Вся теплота, подведенная к термодинамической системе, расходуется на изменение внутренней энергии системы и выполнения работы.
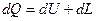
Для 1 кг вещества 1 закон термодинамики имеет вид:
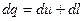
Рассмотрим это уравнение для кругового процесса или цикла:
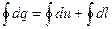 ;
; 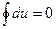

Отсюда следует, что невозможно построить вечный двигатель 1 рода (т.е. с КПД>1).
Для получения второй математической записи 1-го закона термодинамики воспользуемся определением энтальпии:
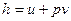 ,
, 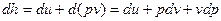
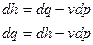
Воспользуемся двумя математическими записями 1-го закона термодинамики для вывода двух важных соотношений для изобарного (p=const) и для изохорного (v=const) процессов.
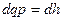 ;
; 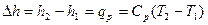

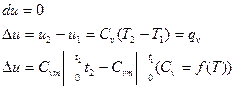
Так как энтальпия h и внутренняя энергия U являются параметрами состояния и их изменение не зависит от вида термодинамического процесса, то полученные выше формулы справедливы для любого термодинамического процесса.
Тема: ОСНОВНЫЕ ТЕРМОДИНАМИЧЕСКИЕ ПРОЦЕССЫ
Термодинамическим процессом называется переход системы из одного состояния в другое, сопровождающийся изменением параметров состояния.
Основные процессы:
- изобарный;
- изохорный;
- изотермический;
- адиабатный;
- политропный.
Дата публикования: 2015-10-09; Прочитано: 456 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
