 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Абсолютное давление
|
|
Давление – это средний результат силового воздействия атомов и молекул на ограничивающие поверхности и определяется как отношение нормальной составляющей силы к площади поверхности.
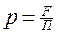 [
[ 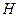 /
/ 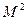 ] = Па
] = Па 
Кроме “Па” для измерения давления используются также такие единицы, как
1 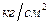 = 1 техническая атмосфера = 735,6 мм.рт.ст.
= 1 техническая атмосфера = 735,6 мм.рт.ст.
1 бар = 105 Па = 750 мм.рт.ст.
Различают барометрическое (атмосферное); манометрическое (избыточное); вакуумметрическое и абсолютное давления.
Абсолютное давление является расчетным и не может быть определено экспериментальным путем.
Давление столба атмосферного воздуха на поверхность земли называется атмосферным давлением.
Рассмотрим определение абсолютного давления газа, находящегося в резервуаре:
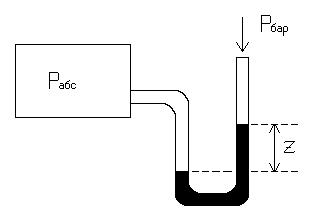
Pмоном = Pабс - Pбар
Pабс = Pмоном + Pбар
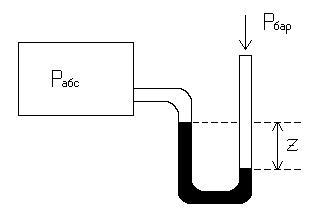
Pвак = Pбар - Pабс
Pабс = Pбар - Pвак
Удельным объемом называется объем, который занимает 1кг вещества.
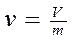 [
[ 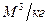 ]
]
Параметром состояния является также величина обратная удельному объему, представляющая собой плотность.
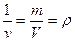 [
[  ]
]
Температура характеризует степень нагретости тела и является мерой интенсивности теплового движения атомов и молекул.
Для измерения температуры используется влияние этого параметра на те или иные физические характеристики вещества (объемное и линейное расширение, электрическое сопротивление, термо - ЭДС, излучательная способность).
Все температурные шкалы делятся на экспериментальные (эмпирические) и расчетные.
Основной экспериментальной шкалой является шкала Цельсия, в которой принято за 00С температура таяния льда, а за 1000С. - температура кипения химически чистой воды при давлении 760 мм.рт.ст.
В настоящее время для измерения температуры используется международная практическая температурная шкала (МПТШ – 68)имеющая не две опорные или реперные точки (как шкала Цельсия), а шесть точек, как области низких, так и высоких температур. За единицу измерения температуры принят 1 градус Цельсия. Кроме этих шкал существуют шкалы Фаренгейта, Реомюра, Ренкина.
Абсолютная термодинамическая шкала температур (шкала Кельвина), является расчетной и имеет одну опорную точку. Этой точкой является тройная точка воды, т.е. температура, при которой находятся в равновесии твердая, жидкая и газообразная фазы.
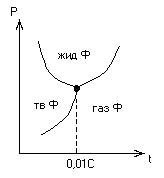
Шкала Кельвина рассчитывается на основании 2-го закона термодинамики. Температура тройной точки воды имеет значение Tл = 273,16 К.
Тема: УРАВНЕНИЕ СОСТОЯНИЯ
Уравнением состояния называется зависимость, устанавливающая связь между термическими параметрами состояния
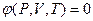
Вид функции 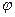 зависит термодинамической природы рабочего тела.
зависит термодинамической природы рабочего тела.
Различают идеальные и реальные газы.
Идеальным газом называется газ, для которого можно пренебречь собственным объемом молекул и силами взаимодействия между ними.
Простейшим уравнением состояния идеального газа является уравнение Менделеева – Клапейрона
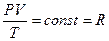 , где
, где
R – зависит от природы газа и называется характеристической газовой постоянной.
Для определения этой величины запишем уравнение Менделеева – Клапейрона для нормальных физических условий, т.е.:
P0 = 760 мм.рт.ст. (101325 Па)
Т0 = 273,15 К (00С)
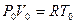 , затем умножим обе части на
, затем умножим обе части на 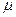 [
[ 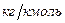 ] – массу kмоля газа (молекулярную массу газа, выраженную в кг).
] – массу kмоля газа (молекулярную массу газа, выраженную в кг).
P0 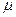 V0 =
V0 = 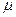 RT0
RT0
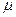
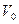 =
= 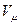 [
[ 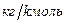
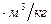 ] = [
] = [ 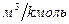 ] = 22,4 м3/kмоль - объем kмоля газа при н.ф.у.
] = 22,4 м3/kмоль - объем kмоля газа при н.ф.у.
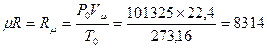 [
[ 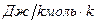 ]
]
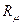 не зависит от природы газа и называется универсальной газовой постоянной.
не зависит от природы газа и называется универсальной газовой постоянной.
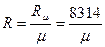 [
[  ]
]
Тема: КAЛОРИЧЕСКИЕ ПАРАМЕТРЫ СОСТОЯНИЯ
1) Внутренняя энергия – представляет собой сумму кинетической энергии теплового движения атомов и молекул, потенциальной энергии их взаимодействия, энергии химических связей, внутриядерной энергии и т.д.
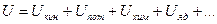
В термодинамических процессах изменяются только первые две составляющие, т.к. энергия химических связей изменяется только при химических превращениях, а внутриядерная - в ядерных реакциях.
В термодинамических расчетах определяется всегда только изменение внутренней энергии и поэтому
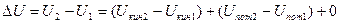
В связи с этим в термодинамике условно принято, что внутренняя энергия состоит из кинетической и потенциальной энергий.
Кинетическая энергия теплового движения атомов и молекул (поступательного, колебательного и вращательного движения) зависит только от температуры, потенциальная – от расстояния между молекулами.
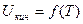
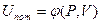
Для идеального газа, когда потенциальной энергией можно пренебречь (Uпот=0), можно записать:
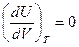
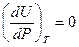 - уравнения Джоуля, которые были получены в результате экспериментальных исследований.
- уравнения Джоуля, которые были получены в результате экспериментальных исследований.
Удельной внутренней энергией называется внутренняя энергия 1 кг вещества.
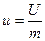 [
[ 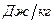 ]
]
Рассмотрим изменение внутренней энергии тела, совершающего круговой процесс или цикл, который лежит в основе работы тепловых машин.
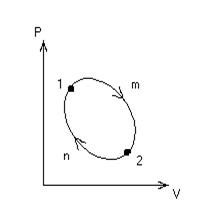

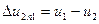
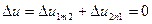
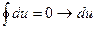 представляет собой полный дифференциал функции внутренней энергии:
представляет собой полный дифференциал функции внутренней энергии:

2) Энтальпи я.
Рассмотрим полный запас энергии газа, находящегося в резервуаре с поршнем.
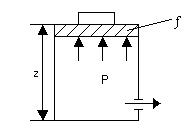 Полный запас энергии газа обозначим через Н и он равен:
Полный запас энергии газа обозначим через Н и он равен: 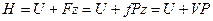
Энтальпия – это сумма внутренней энергии газа и потенциальной энергии давления. Удельная энтальпия – это энтальпия 1 кг вещества, т.е.
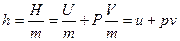
Для идеального газа энтальпия зависит только от температуры, так как
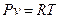
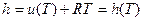
В общем случае удельная энтальпия зависит только от параметров состояния (u,p,T) и поэтому сама является параметром состояния.
Т.к. в расчетах всегда определяются изменения внутренней энергии и энтальпии, точка начала отсчета для этих величин в ТТ принята условно, т.е. 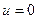 ;
; 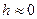 ;
; 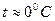 .
.
3) Энтропия – это такой параметр состояния, дифференциал которого равен отношению бесконечно малого количества теплоты, подведенного или отведенного в обратимом термодинамическом (т/д) процессе, к абсолютной температуре, которая в данном процессе остается постоянной.
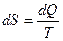 ,
, 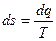
 ,
, 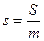
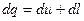
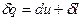 ,
, 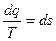
Другими словами энтропия – такой параметр состояния, изменение которого свидетельствует о наличии в системе энергетического взаимодействия в виде обмена теплотой.
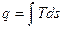 ; если
; если 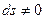 , то q≠0, т.е. в системе присутствует теплообмен.
, то q≠0, т.е. в системе присутствует теплообмен.
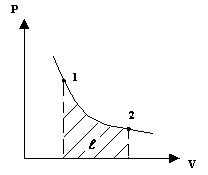
Тема: ОПРЕДЕЛЕНИЕ МЕХАНИЧЕСКОЙ РАБОТЫ (РАБОТЫ ИЗМЕНЕНИЯ ОБЪЕМА)
Определим механическую работу, которую совершает термодинамическая система в результате изменения ее объема.
работа - 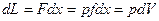
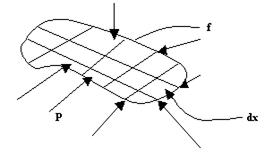
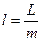 ;
; 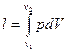
Значение интеграла зависит от вида подинтегральной функции, т.е. от вида т/д процесса.
Работа 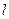 имеет не только абсолютное значение, но и знак
имеет не только абсолютное значение, но и знак 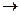 (если
(если 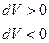
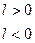 )
)
Дата публикования: 2015-10-09; Прочитано: 1125 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
