 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
З а д а ч і 1 страница
|
|
1. Визначити теплоту qр, роботу та зміну внутрішньої енергії при перетворенні 36 г води в пару при сталому тиску і температурі 373 К, коли відомо, що за цих умов молярна теплота випаровування води дорівнює 40,905 кДж/моль. Вважати пару ідеальним газом. Об’ємом рідини знехтувати. Відповідь: 81,81 кДж; 6,20 кДж; 75,61 кДж.
2. Визначити ∆H і роботу при плавленні 2,698 г алюмінію, коли відомо, що при тиску 1,01325 ∙ 105 Па і температурі плавлення 933,1 К зміна мольного об’єму алюмінію дорівнює 0,51 ∙ 10-3 л/моль. Теплота плавлення алюмінію дорівнює 10,76 кДж/моль. Відповідь: 1,08 кДж; 5,17 Дж.
3. Визначити теплоту, роботу і ∆U випаровування 92,14 кг етанолу, коли відомо, що при тиску 1,01325 ∙ 105 Па і температурі кипіння теплота випаровування дорівнює 47,5 МДж/кмоль і питомий об’єм пари становить 0,607 м3/кг. Об’ємом рідини знехтувати. Молярну масу етанолу виразити в кг/кмоль. Відповідь: 95 МДж; 5,67 МДж; 89,33МДж.
4. 180 г водяної пари конденсується в рідину при температурі 373 К і тиску 1,01325 ∙ 105 Па. Теплота випаровування води дорівнює 40,905 кДж/моль. Обчислити теплоту, роботу і зміну внутрішньої енергії, вважаючи пару ідеальним газом і нехтуючи об’ємом рідини. Відповідь: - 409,05 кДж; - 31,01 кДж; - 378,04 кДж.
5. Яка робота буде виконана 44 г СО2 при підвищенні температури на 100 К і сталому тиску? Відповідь: 831,4 Дж.
6. Яка кількість теплоти виділиться при ізотермічному стисканні 0,1 м3 ідеального газу, взятого при 298 К і тиску 1,01325 ∙ 105 Па, якщо об’єм його зменшиться в 10 разів? Відповідь: - 25,44 кДж.
7. Визначити середню питому теплоємність заліза в інтервалі температур від 290 до 373 К, знаючи, що для заліза залежність мольної теплоємності від температури визначається рівнянням: Ср = 14,11 + 29,73 ∙ 10-3Т. Відповідь: 0,43 Дж/(г∙К).
8. Визначити ∆Н перетворення α-Fe в γ-Fe при 1200 К, якщо перетворення відбувається при 1183 К з поглинанням тепла (∆Н0 = 903 Дж/моль). При цій температурі Ср(α-Fe) = 41,29 Дж/(моль∙К), Ср(γ-Fe) = 34,23 Дж/(моль∙К). Прийняти, що в даному температурному інтервалі Ср не залежить від Т. Відповідь: 782,88 Дж/моль.
9. Розрахувати ∆Н випаровування води при 600С при умові, що теплоємності пари і рідкої води в інтервалі від 40 до 600С не залежать від температури і відповідно рівні35,57 Дж/(моль∙К) і 75,47 Дж/(моль∙К), а ∆Н випаровування при 400С складає 44,1 кДж/моль. Відповідь: 43,3 кДж/моль.
10. Обчислити молярну середню теплоємність свинцю в інтервалі температур від 273 до 373 К, знаючи, що для свинцю залежність істинної молярної теплоємності від температури визначається рівнянням: Ср = 26,61 + 9,63 ∙ 10-3Т. Відповідь: 26,72 Дж/(моль∙К).
11. Молярна теплоємність оксиду кальцію визначається рівнянням: Ср = 4,186 + 20,26 ∙ 10-3Т. Визначити кількість теплоти, яка потрібна для нагрівання 100 г оксиду кальцію від 290 до 890 К. Відповідь: 17,3кДж.
12. Визначити стандартну ∆Н0 утворення карбонату кальцію з простих речовин, користуючись такими даними:
Са + 1/2О2 = СаО, ∆Н01 = - 635,1 кДж;
С + О2 = СО2, ∆Н02 = - 393,78 кДж;
СаО + СО2 = СаСО3, ∆Н03 = - 178,62 кДж.
Відповідь: - 1207, кДж.
13. Визначити Qp i QV при 298 К для реакції FeO(тв.) + H2(г) = Fe(тв.) + H2O(рід.). Стандартні теплоти утворення (Qp) FeO(тв.) і H2O(рід.) відповідно дорівнюють 266,7 і 286,0 кДж/моль. Відповідь: 19,33 кДж; 16,86 кДж.
14. Визначити теплоту утворення води з водню і кисню (QV) при V = const і Т = 298 К, якщо теплота утворення води при р = const і Т = 298К дорівнює 286,03 кДж/моль. Відповідь: 282,32 кДж/моль.
15. Визначити ∆Н утворення оксиду цинку при 500 К і р = const, якщо ∆Н0298(ZnO) = -348,3 кДж/моль, а температурні залежності теплоємностей даються рівняннями:
CpZn = 22,4 + 10,05 ∙ 10-3T;
CpO2 = 34,62 + 1,08 ∙ 10-3T;
CpZnO = 49,03 + 5,11 ∙ 10-3T.
Відповідь: 1,09 кДж/моль.
16. При 2023 К ∆Н випаровування свинцю дорівнює 177,9 Дж/моль. Визначити ∆Н випаровування свинцю при 2500 К, якщо мольні теплоємності рідкого і газоподібного свинцю можна розрахувати за рівняннями:
Сррід. = 32,45 – 3,06 ∙ 10-3T;
Срг. = 20,81.
Відповідь: - 175,65 Дж/моль.
17. Газ, розширюючись при постійному тиску 1 атм. Від 10 до 16 л, поглинає1254 Дж тепла. Визначити зміну внутрішньої енергії. (1 л∙атм/моль = 101,33 Дж/моль). Відповідь: 646 Дж.
18. Яка кількість тепла необхідна для нагрівання 1 м3 повітря від 0 до 10С при постійному об’ємі і початковому тиску 1 атм? Густина повітря при нормальних умовах дорівнює 0,00129г/мл; Ср = 1 Дж/(г∙К); Ср/СV = 1,4. Відповідь: 921 Дж.
19. Питома теплоємність алюмінію виражається рівнянням: Ср = 0,183 + 1,096 ∙ 10-4T. Алюміній плавиться при 658,50С, його питома теплота плавлення дорівнює 386,2 Дж/г. Обчислити, скільки тепла знадобиться на розплавлення 500 г алюмінію, якщо початкова температура була 250С. Відповідь: 524,6 кДж.
20. Знайти ∆Н утворення аміаку на основі наступних даних:
2Н2 + О2 = 2Н2О, ∆Н = -571,13 кДж;
4NH3 + 3O2 = 6H2O + 2N2, ∆Н = -1528,80 кДж.
Відповідь: - 46,15 кДж/моль.
21. Теплота розчинення BaCl2 (QBaCl2) у воді дорівнює 8,653 кДж; теплота гідратації BaCl2 (Qh) з утворенням BaCl2∙2Н2О дорівнює 29,135 кДж. Чому дорівнює теплота розчинення BaCl2∙2Н2О? Відповідь: - 20,482 кДж.
22. Знайти теплоту розкладу Н2О2 (QН2О2) на основі наступних даних:
SnCl2 + 2HCl + 1/2O2 = SnCl4 + H2O + 296,3 кДж;
SnCl2 + 2HCl + H2O2 = SnCl4 + 2H2O + 393,0 кДж.
Відповідь: 96,7 кДж.
23. Знайти тепловий ефект (Qх.р.) реакції CuS + O2 = Cu + SO2 при 7270С і тиску 1 атм. На основі наступних даних: Q утворення CuS і SO2 при 250С і 1 атм. Відповідно рівні 48,488 і 296,613 кДж/моль. Молярні теплоємності речовин задаються рівняннями:
Ср(CuS) = 10,6 + 2,64 ∙ 10-3T;
Ср(О2) = 6,502 + 1,738 ∙ 10-3T;
Ср(Cu) = 5,43 + 1,41 ∙ 10-3T;
Ср(SO2) = 11,40 + 1,714 ∙ 10-3T.
Відповідь: 251,31 кДж.
24. Молярна теплота випаровування бензолу (λ1) при 00С дорівнює 32,65 кДж/моль. Середня питома теплоємність парів бензолу в межах від 0 до 800С дорівнює 1,25 Дж/(г∙К). Середня питома теплоємність рідкого бензолу в тому ж температурному інтервалі дорівнює 1,72 Дж/(г∙К). Визначити молярну теплоту випаровування бензолу (λ2) при 800С. Відповідь: 29,72 кДж/моль.
25. Вважаючи Ср кисню рівним 7/2 R і постійним, обчислити зміну ентропії при нагріванні 3,2 г кисню від 0 до 1000С: а) при постійному тиску; б) при постійному об’ємі. Відповідь: 0,908; 0,649 (Дж/град.).
26. Визначити зміну ентропії при нагріванні 1 моль срібла від 25 до 2250С. Молярна теплоємність срібла виражається рівнянням: Ср = 5,593 + 1,49 ∙ 10-3Т. Відповідь: 3,17 Дж/(моль ∙ К).
27. Визначити зміну ентропії при плавленні 1 кг міді. Питома теплота плавлення міді дорівнює 173,9 Дж/г, температура плавлення міді 10830С. Відповідь: 128,2 Дж/град.
28. Визначити стандартну зміну ізобарно-ізотермічного потенціалу для реакції ZnS + H2 = Zn + H2S за такими даними ∆Н0ZnS = - 201,8 кДж/моль; ∆Н0H2S = - 20,1 кДж/моль; S0ZnS = 57,78 Дж/(моль ∙ К); S0H2 = 306,74 Дж/(моль ∙ К); S0Zn = 41,66 Дж/(моль ∙ К); S0H2S = 205,57 Дж/(моль ∙ К). Чи може протікати ця реакція за стандартних умов? Відповідь: 216,65 кДж.
29. Обчислити зміну ентропії при нагріванні 11,87 г олова від 298 до 498 К. Залежність молярної теплоємності олова від температури визначається рівнянням Ср = 18,51 + 26,387∙10-3Т. Відповідь: 1,478 Дж/град.
30. При 626 К α-Ni переходить в β-Ni. Обчислити зміну ентропії 5,871 г нікелю при нагріванні його від 298 К до температури фазового переходу, якщо залежність Ср від температури дається рівнянням: Ср = 17 + 29,48∙10-3Т. Відповідь: 2,227 Дж/град.
31. Визначити зміну ентропії при переході 5,871 г β-Ni від 626 К в рідкий стан, якщо теплота плавлення β-Ni при 1728 К дорівнює 17,63 кДж/моль, а теплоємність β-Ni визначається рівнянням: Ср = 25,2 + 7,536∙10-3Т. Відповідь: 4,41 Дж/град.
32. Визначити зміну ентропії при нагріванні 1 м3 СО2 від 298 до 1000 К при тиску 1,01325 ∙ 105 Па. Залежність молярної теплоємності СО2 від температури виражається рівнянням: Ср = 32,24 + 22,2 ∙ 10-3Т. Відповідь: 2,44 кДж/град.
33. Ентропія α-заліза за стандартних умов дорівнює 27,177 Дж/(моль ∙ К). Залежність теплоємності α-заліза від температури дається рівнянням: Ср = 14,11 + 29,73 ∙ 10-3Т. При 1033 К α-залізо перетворюється в β-залізо. Визначити ентропію α-заліза при температурі фазового переходу. Відповідь: 66,57 Дж/(моль ∙ К).
34. Обчислити ∆U і ∆F для реакції Ag + 1/2Cl2 = AgCl при 298 К і 1 атм., якщо ∆Нреакції = -127,068 кДж/моль і ∆Gреакції = -109,748 кДж/моль. Відповідь: -125,829; -108,509 кДж/моль.
35. Розрахувати ∆G при 400 К для реакції 0,5N2 + 1,5H2 = NH3, якщо ∆G при 298 К дорівнює –16,496 кДж/моль; S0NH3 = 192,5; S0N2 = 191,5; S0H2 = 130,6 Дж/моль . К. Відповідь: - 6,383 кДж/моль.
36. Розрахувати зміну ентропії при нагріванні 58,82 г В2О3 від 298 до 700 К, теплоємність В2О3 СР = 36,5525 + 106,345 . 10-3Т (Дж/(моль . К)). Відповідь: 62,5 Дж/(моль . К).
37. Бромбензол кипить при 429,8 К, його теплота пароутворення при цій температурі 241,9 Дж/г. Розрахувати зміну ентропії при випаровуванні 1 молю бромбензолу. Відповідь: 88,4 Дж/(моль . К).
38. Чи буде взаємодіяти водень з киснем за реакцією 2Н2+ О2 = 2Н2О при 180 К і 1,013 . 105 Па, якщо ∆G0298 Н2О = -237,19 кДж/моль; S0H2 = 130,6; S0О2 = 205,03; S0H2О = 69,94 Дж/(моль . К). Відповідь: ∆G0180 Н2О = -275,7 кДж, буде.
39. Чи буде взаємодіяти азот з воднем за реакцією 3Н2 + N2 = 2NH3 при 700 К і тиску 1 атм., якщо ∆G0298 NH3 = - 17,0 кДж/моль; S0H2 = 130,6; S0N2 = 191,5; S0NH3 = 192,5 Дж/(моль . К). Відповідь: ∆G0700 NH3 = 62,7 кДж, не буде.
40. Обчислити зміну ізобарного потенціалу при ізотермічному стисканні 10-2 м3 кисню. Початковий і кінцевий тиск відповідно дорівнюють 1,01325 . 105 Па і 1,01325 МПа, температура 273 К. Відповідь: 2,33 кДж.
41. В якому напрямку буде протікати реакція ZnS + H2 = Zn + H2S за стандартних умов, якщо: ∆Н0298 ZnS = - 201,8; ∆Н0298 H2S = - 20,1 кДж/моль; S0298 ZnS = 57,78; S0298 H2 = 306,74; S0298 Zn = 41,66; S0298 H2S = 205,57 Дж/(моль . К). Відповідь: ∆G0х.р. = 216,75 кДж, в зворотному напрямку.
42. Обчислити зміну ізобарного потенціалу при ізотермічному стисненні 160 г кисню від 0,101325 . 106 до 1,01325 . 106 Па, якщо температура газу становить 300 К. Відповідь: 28,635 кДж.
43. Визначити ізобарний потенціал утворення СО2 при 298 і тиску 1,01325 . 105 Па, якщо в стандартних умовах він дорівнює 394,8 кДж/моль. Відповідь: - 360,63 кДж.
44. В якому напрямку піде реакція ZnO + CO = Zn + CO2 при 298 К, якщо теплоти утворення ZnO, CO і CO2 відповідно дорівнюють 348,3; 110,6 і 393,78 кДж/моль, а ентропії ZnO, CO, Zn і CO2 - відповідно 43,5; 198,04; 41,66 і 213,78 Дж/(моль . К). Відповідь: ∆G0х.р. = 60,978 кДж/моль, реакція піде в зворотному напрямку.
45. Побудувати графічну залежність ∆G від температури для реакції С6Н6(р) + 7/2 О2(г) = 6 СО2(г) + 3 Н2О(г), ∆Н = -3037,5 кДж. Як впливає зміна температури на протікання прямої і зворотної реакції?
46. Побудувати графічну залежність ∆G від температури для реакції СН3ОН(р) + 3/2 О2(г) = СО2(г) + 2Н2О(р), ∆Н = -726,6 кДж. Як впливає зміна температури на протікання прямої і зворотної реакції?
47. При яких температурах буде протікати пряма, а при яких - зворотна реакція СО(г) + 2Н2(г) ↔ СН3ОН(г), ∆Н = -128,05 кДж, якщо ентропії учасників реакції відповідно рівні: 197,91; 130,59 і 126,8 Дж/(моль . К). Відповідь: при Т < 385 К – пряма.
48. При яких температурах буде протікати пряма, а при яких - зворотна реакція СН4(г) + СО2(г) ↔ 2СО(г) + 2Н2(г), ∆Н = 247,37 кДж, якщо ентропії учасників реакції відповідно рівні: 186,19; 213,65; 197,91 і 130,59 Дж/(моль . К). Відповідь: при Т > 962 К – пряма.
49. Тиск пари метанолу при 200С дорівнює 94 мм.рт.ст., а при 400С – 259,4 мм.рт.ст. Визначити середнє значення теплоти випаровування спирту у вказаному інтервалі температур. Відповідь: 38,7 кДж/моль.
50. Молярна теплота випаровування CCl4 змінюється з температурою за рівнянням: λ = 10960 – 10,53Т. Визначити тиск насиченої пари CCl4 при 600С, якщо відомо, що CCl4 кипить при 750С під тиском 760 мм.рт.ст. Відповідь: 677 мм.рт.ст.
51. Константа рівноваги Кр реакції С + СО2 ↔ 2СО при 1000 К дорівнює 1,862. Знайти константу рівноваги при 1200 К, якщо середнє значення теплового ефекту Qp дорівнює –169,4 кДж. Відповідь: 55,56.
52. При 676 К константа рівноваги (Кр) реакції MgCO3 ↔ MgO + CO2 дорівнює 1. ∆Н = 117,49 кДж. Знайти Кр при 700 К, вважаючи, що ∆Н в цьому інтервалі температур не змінюється. Відповідь: 2,05.
53. Пружність пари аміаку над HgCl∙NH3 дорівнює 35,2 мм.рт.ст. при 1670С і 66,2 мм.рт.ст при 1850С. Визначити середнє значення теплового ефекту (∆Н) реакції HgCl∙NH3 ↔ HgCl + NH3. Відповідь: 58,8 кДж.
54. Константа рівноваги реакції 2СО2 ↔ 2СО + О2 Кр = 10-20 при 1000 К. Обчислити константу рівноваги цієї реакції при 2000 К, якщо середнє значення теплового ефекту Qp дорівнює - 560,8 кДж. Відповідь: 4,44 ∙ 10-6
55. При якій температурі константа рівноваги реакції СО + Н2О ↔ СО2 + Н2 дорівнює 27,56, якщо при 1080 К Кр = 1? Тепловий ефект реакції (Qp) вважати рівним 41,16 кДж. Відповідь: 626,6 К.
56. Пружність дисоціації СаСО3 при 1150 К дорівнює 0,66 атм. Теплота дисоціації (Qp) дорівнює -167,2 кДж. Визначити температуру, при якій пружність дисоціації карбонату кальцію, що протікає за рівнянням СаСО3 → СаО + СО2, дорівнює 1 атм. Відповідь: 1176 К.
57. Константа рівноваги реакції 2А + В = 2С + D, де всі учасники – гази, дорівнює 2. В який бік піде реакція в суміші, що складається з 20 мол.% А, 30 мол.% В, 30 мол.% С і 20 мол.% D? Відповідь: праворуч.
58. Константа рівноваги реакції А + В = С + D, де всі учасники – гази, дорівнює 4. В який бік піде реакція в суміші, що складається з 10 мол.% А, 20 мол.% В, 30 мол.% С і 40 мол.% D? Відповідь: ліворуч.
59. Константа рівноваги реакції А + В = С + D, де всі учасники – гази, дорівнює 6. В який бік піде реакція в суміші, що складається з 10 мол.% А, 20 мол.% В, 30 мол.% С і 40 мол.% D? Відповідь: стан рівноваги.
60. Константа рівноваги реакції 2А + В = 2С + D, де всі учасники – гази, дорівнює 1,5. В який бік піде реакція в суміші, що складається з 20 мол.% А, 30 мол.% В, 30 мол.% С і 20 мол.% D? Відповідь: стан рівноваги.
61. Визначити зміну вільної енергії Гіббса при перетворенні 1 моль СО при тиску 2 атм. і 1 моль Cl2 при тиску 3 атм. в 1 моль СОCl2 при тиску 0,5 атм., якщо Т = 6000С і Кр для реакції СО + Cl2 ↔ СОCl2 дорівнює 0,766. Відповідь: - 16,1 кДж.
62. Визначити константу рівноваги (Кр) для реакції 2С + 3Н2 ↔ С2Н6 при 298 К, якщо: So298(C2H6) = 229,3; So298(C) = 5,7; So298(H2) = 130,5 Дж/(моль К) і ∆Но298(С2Н6) = -84586,5 Дж/моль. Відповідь: 5,74 ∙ 105.
63. Визначити константу рівноваги (Кр) для реакції 6С + 3Н2 ↔ С6Н6 при 298 К, якщо: So298(C6H6) = 269,4; So298(C) = 5,7; So298(H2) = 130,5 Дж/(моль К) і ∆Но298(С6Н6) = 82,848 кДж/моль. Відповідь: 2,06 ∙ 10-23.
64. Визначити константу рівноваги (Кр) реакції Н2 + Cl2 ↔ 2НCl при 250С, якщо її тепловий ефект (Qp) при цій температурі дорівнює 184446,7 Дж, а So298(H2) = 130,5; So298(Cl2) = 222,7; So298(НCl) = 186,5 Дж/(моль К). Відповідь: 2,3 ∙ 1033.
65. Визначити хімічну спорідненість і напрямок реакції СО + Н2О ↔ СО2 + Н2 при одиничних концентраціях учасників реакції і температурах 1000 і 1200 К, якщо константи рівноваги Кр при цих температурах відповідно дорівнюють 1,39 і 0,71. Відповідь: -2,738 кДж; 3,417 кДж.
66. Константа рівноваги реакції СО + Н2О ↔ СО2 + Н2 при 800 К дорівнює 4,12. В який бік піде реакція в суміші, склад якої (у мол.%) СО – 10; Н2О – 20; СО2 – 40; Н2 – 30? Відповідь: ліворуч.
67. Константа рівноваги реакції СО + Н2О ↔ СО2 + Н2 при 1500 К дорівнює 6,46. В який бік піде реакція в суміші, склад якої (у мол.%) СО – 30; Н2О – 10; СО2 – 40; Н2 – 20? Відповідь: праворуч.
68. Константа рівноваги реакції А + В ↔ С + D, де всі учасники – гази, дорівнює при 1000 К 2,46. В який бік піде реакція в суміші, склад якої (у мол.%) А – 10; В – 20; С – 40; D – 30? Відповідь: ліворуч.
69. Визначити хімічну спорідненість заліза до кисню повітря (РО2 = 0,212 ∙ 105 Па) при 1000 К, якщо константа рівноваги реакції 2Fe + O2 ↔ 2FeO при цій температурі дорівнює 3,39 ∙ 1015 Па-1. Відповідь: -380,1 кДж.
70. Тиск водяної пари над системою CuSO4 ∙ 5H2O ↔ CuSO4 ∙ 3H2O + 2H2O при 308 К дорівнює 2,077 ∙ 103 Па, а при 298 К – 0,98 ∙ 103 Па. Визначити тепловий ефект цієї реакції (Qp). Відповідь: -57,3 кДж.
71. Константа рівноваги (Кр ) реакції 2А + В = 2С при 800 К дорівнює 10-16. Обчислити Кр цієї реакції при 1000 К, якщо середнє значення теплового ефекту (Qp) реакції дорівнює -480,6 кДж. Відповідь: 1,9 ∙ 10-10 .
72. Визначити константу рівноваги реакції N2 + 3H2 ↔ 2NH3 при 600 К на основі наступних даних: ∆Sх.р298 = -198 Дж/К; ∆Нх.р.298 = -92,294 кДж; ∆Ср = 38,79 Дж/К. Відповідь: 1,23 ∙ 10-2 .
73. Скориставшись діаграмою стану системи олово-цинк (рис. 1):
1) визначити масу і склад фаз, на які розпадається 10 кг 90%-ного за цинком розплаву, охолодженого до точки В;
2) яким станам системи (гомогенні чи гетерогенні) відповідають області, позначені римськими літерами. Які фази співіснують в цих областях?
3) Скільки ступенів свободи має система в точках 1-6?

|


|

|

|
|


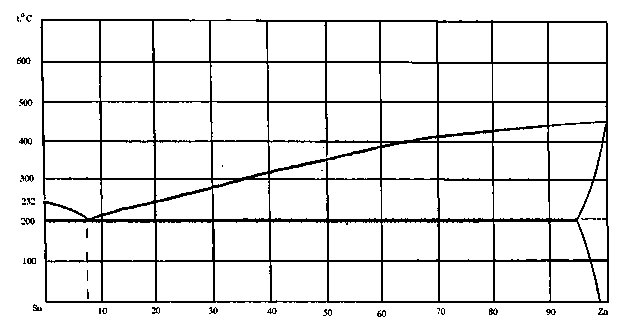
Рисунок 1 – Діаграма стану олово-цинк
74. Скориставшись діаграмою стану системи кадмій-цинк (рис.2):
1) визначити масу і склад фаз, на які розпадається 10 кг 90%-ного за цинком розплаву, охолодженого до точки В;
2) яким станам системи (гомогенні чи гетерогенні) відповідають області, позначені римськими літерами. Які фази співіснують в цих областях?
3) Скільки ступенів свободи має система в точках 1-6?


|

|



|

|
|
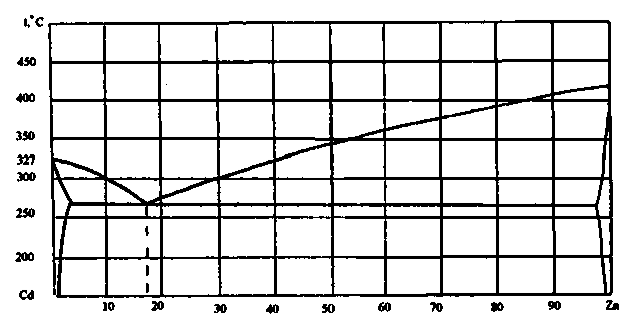
Рисунок 2 – Діаграма стану кадмій-цинк
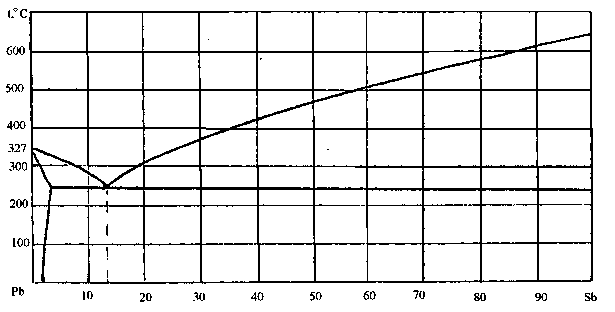
75. Скориставшись діаграмою стану системи свинець-стибій (рис. 3):
1) визначити масу і склад фаз, на які розпадається 10 кг 90%-ного за сурьмою розплаву, охолодженого до точки В;
2) яким станам системи (гомогенні чи гетерогенні) відповідають області, позначені римськими літерами. Які фази співіснують в цих областях?
3) Скільки ступенів свободи має система в точках 1-6?


|



|


|
|
|
Дата публикования: 2015-09-18; Прочитано: 2402 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
